Experimentele sunt un mod practic de a învăța și de a testa cunoștințele despre conceptele studiate în chimie.
Profitați de aceste experimente chimice, care pot fi făcute acasă (sub supravegherea unui adult) sau lucrate în clasă cu profesorul, pentru a vă completa studiile.
Prima experiență - dezlegarea culorilor
Concepte implicate: cromatografie și separarea amestecurilor
Materiale
- pixuri (marcaje marcate) de diferite culori
- alcool
- hârtie de filtru de cafea
- ceașcă (pahar pentru a facilita monitorizarea experimentului)
Modul de a face
- Folosiți foarfece și tăiați benzi de hârtie de filtru. Pentru fiecare stilou folosit, faceți un dreptunghi.
- Acum, la o distanță de aproximativ 2 cm de bază, trageți un cerc cu stiloul colorat ales și vopsiți tot interiorul.
- Lipiți marginea hârtiei cel mai îndepărtat de marmura trasă pe un suport. Pentru aceasta, puteți utiliza o bandă și o puteți atașa la un creion.
- Adăugați alcool în ceașcă, nu prea mult, deoarece ar trebui să atingă doar capătul hârtiei lângă semnul stiloului.
- Așezați hârtia în cupă astfel încât să fie verticală. Creionul care îl susține ar trebui să se sprijine pe margini.
- Așteptați între 10 și 15 minute pentru ca alcoolul să crească prin hârtia de filtru. După aceea, scoateți hârtiile și lăsați-le să se usuce.
Rezultat
Când alcoolul trece prin semnul stiloului, acesta interacționează cu componentele de culoare și le conduce pe hârtie. Astfel, diferiții pigmenți vor fi separați prin contactul cu alcoolul.
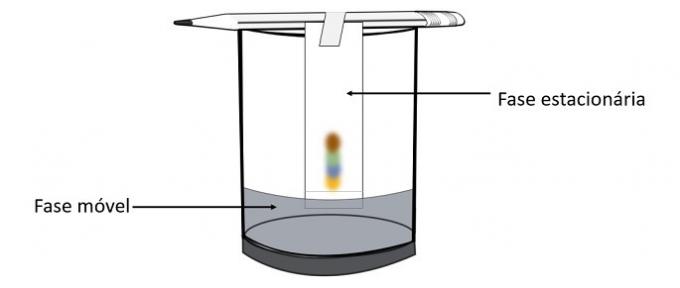
Prin acest experiment este posibil să știm ce culori au fost amestecate pentru a crea culoarea stiloului.
Explicaţie
Cromatografia este un tip de proces de separare a amestecurilor. Hârtia de filtru este faza staționară, iar alcoolul este faza mobilă care trage componentele amestecului pe măsură ce trece prin faza staționară. În acest proces, cu cât interacțiunea cu alcoolul este mai mare, cu atât pigmentul se va deplasa mai rapid cu trecerea solventului.
Constituenții materialului, deoarece au proprietăți diferite, vor interacționa cu faza mobilă în moduri diferite, care pot fi observate de diferiții timpi de tragere în faza staționară.
Află mai multe despre cromatografie.
A doua experiență - conservarea alimentelor
Concepte implicate: compuși organici și reacții chimice
Materiale
- măr, banană sau pere
- suc de lamaie sau portocala
- Comprimat de vitamina C
Modul de a face
- Alegeți unul dintre cele trei fructe și tăiați-l în 3 părți egale.
- Prima piesă va servi ca o comparație cu celelalte. Deci, nu adăugați nimic la el, lăsați-l doar expus la aer.
- Într-una dintre bucăți, picurați conținutul unei lămâi sau unei portocale. Se întinde astfel încât întregul interior al fructului să fie acoperit cu suc.
- În ultima parte, răspândiți vitamina C, poate fi o tabletă zdrobită, peste toată pulpa de fructe.
- Urmăriți ce se întâmplă și comparați rezultatele.
Rezultat
Pulpa fructului care a fost expusă aerului ar trebui să se întunece rapid. Sucul de lămâie sau portocală și vitamina C, o substanță chimică numită acid ascorbic, ar trebui să încetinească rumenirea fructelor.

Explicaţie
Când tăiem un fruct, celulele sale sunt deteriorate eliberând enzime cum ar fi polifenol oxidaza, care în contactul cu aerul oxidează compușii fenolici prezenți în alimente și provoacă o rumenire enzimatică.
Pentru a preveni acțiunea oxigenului, se folosesc conservanți precum acidul ascorbic, deoarece sunt preferați oxidați în locul compușilor fenolici. Pe lângă tableta de vitamina C, acidul ascorbic este prezent și în surse naturale, cum ar fi citricele, lămâia și portocala, sugerate în experiment.
Află mai multe despre oxidare.
A 3-a experiență - cine îngheață mai repede?
Concepte implicate: proprietăți coligative și crioscopie
Materiale
- două tuburi (folosite pentru favoruri de petrecere)
- bol de sticlă
- sare de masă
- apa filtrata
- gheaţă
- termometru
Modul de a face
- Adăugați aceeași cantitate de apă filtrată la ambele tuburi. De exemplu, 5 ml în fiecare tub.
- Adăugați sarea de masă la unul dintre tuburi și plasați o bandă de identificare pentru a distinge care este sărată.
- Umpleți recipientul de sticlă cu gheață zdrobită și adăugați puțină sare.
- Așezați simultan cele două tuburi în interiorul gheții și urmăriți ce se întâmplă.
- Înregistrați temperatura de îngheț pentru fiecare situație.
Rezultat
Adăugarea unui solut în apă scade temperatura de îngheț. Prin urmare, apa simplă tinde să înghețe mult mai repede decât o soluție de sare și apă atunci când este expusă în aceleași condiții.
Explicaţie
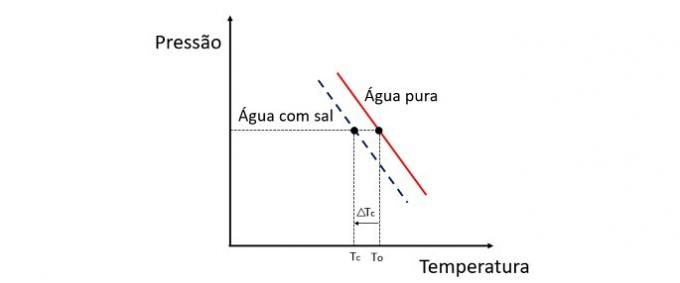
Crioscopia este o proprietate coligativă care studiază variația temperaturii unui solvent atunci când diferite cantități de substanță dizolvată sunt dizolvate în el.
Scăderea temperaturii de îngheț a apei este cauzată de un dizolvat nevolatil și acest fenomen are multe aplicații practice. Prin urmare, cu cât concentrația de solut în soluție influențează efectul crioscopic.
Dacă, de exemplu, apa îngheață la 0 ° C și adăugăm sare la ea, temperatura de schimbare a fazei va fi negativă, adică mult mai mică.
Acesta este motivul pentru care apa de mare nu îngheață în locuri a căror temperatură este sub 0 ° C. Sarea dizolvată în apă tinde să scadă și mai mult temperatura de îngheț. În locurile în care este zăpadă, este de asemenea obișnuit să arunci sare pe drumuri pentru a topi gheața și a evita accidentele.
Află mai multe despre proprietati coligative.
Al patrulea experiment - descompunerea peroxidului de hidrogen
concepte implicate: reacție chimică și catalizator
Materiale
- O jumătate de cartof crud și jumătate gătit
- O bucată de ficat crud și altă bucată gătită
- Apă oxigenată
- 2 feluri de mâncare
Modul de a face
- În fiecare fel de mâncare adăugați alimente, cartofi împreună și ficat împreună.
- În fiecare dintre cele patru materiale adăugați 3 picături de peroxid de hidrogen.
- Urmăriți ce se întâmplă și comparați rezultatele.
Rezultat
Peroxidul de hidrogen, o soluție de peroxid de hidrogen, când intră în contact cu alimentele crude, începe să efervescențe aproape instantaneu.
Acest experiment se poate face și prin adăugarea unei bucăți de alimente într-un recipient cu apă oxigenată pentru a face reacția mai vizibilă.
Explicaţie
Efervescența prezentată de peroxidul de hidrogen la intrarea în contact cu alimentele crude caracterizează apariția unei reacții chimice, care este descompunerea peroxidului de hidrogen și eliberarea gazului oxigen.
Descompunerea peroxidului de hidrogen are loc prin acțiunea enzimei catalazei, care se găsește în organul peroxizomilor, prezent în celulele animale și vegetale.
Este important să rețineți că descompunerea peroxidului de hidrogen are loc spontan, în prezența soarelui, dar într-o reacție foarte lentă. Cu toate acestea, catalaza acționează ca un catalizator, crescând viteza reacției chimice.
Peroxidul de hidrogen poate fi o substanță toxică pentru celule. Prin urmare, catalaza descompune compusul și produce apă și oxigen, două substanțe care nu dăunează organismului.
Când alimentele sunt gătite, componentele sale suferă modificări. Modificările cauzate de gătit compromit și acțiunea catalazei prin denaturarea proteinei.
Aceeași acțiune pe care o vedem cu mâncarea este ceea ce se întâmplă atunci când punem peroxid de hidrogen pe o rană. Catalaza acționează și există formarea de bule, care constă în eliberarea de oxigen.
Află mai multe despre reacții chimice.
Referințe bibliografice
SFÂNȚII, W. L. P.; MOL, G. S. (Coords.). Chimia cetățenească. 1. ed. São Paulo: Noua generație, 2011. v. 1, 2, 3.
SOCIETATEA CHIMICĂ A BRĂZILIEI (org.) 2010. Chimie lângă tine: experimente la preț redus pentru clasa K-12. 1. ed. Sao Paulo.