Radioactivitate este proprietatea pe care unii atomi, cum ar fi uraniu și radio, trebuie să emită spontan energie in forma particule și val, devenind elemente chimice mai stabil și mai ușor.
Tipuri
Radioactivitatea se prezintă cu doua feluri radiații diferite: particule - alfa (α) și beta (β); și unde electromagnetice - raze gamma (γ).
raze alfa: sunt particule pozitive formate din doi protoni și doi neutroni și cu putere de penetrare redusă.
razele beta: sunt particule negative care nu conțin masă constând dintr-un electron (masă neglijabilă), iar puterea lor de penetrare este mai mare decât cea a razelor alfa, dar mai mică decât cea a razelor gamma.
Gamma: sunt unde electromagnetice de mare energie și, întrucât nu sunt particule, nu au, de asemenea, masă.
Citește și tu: Formule de radioactivitate
Nu te opri acum... Există mai multe după publicitate;)
legile
Emisia radioactivă a particulelor urmează anumite comportamente care sunt explicate de legile radioactivitate (una pentru particula alfa și una pentru particula beta), care au fost descrise de chimist Engleză
Frederick Soddyși de către chimistul și fizicianul polonez Kazimierz Fajans.Prima lege a radioactivității
Conform acestei legi, atunci când un atom radioactiv emite radiații de tip alfa, acesta va da naștere unui atom nou cu miez care conține doi protoni și doi neutroni mai puțin, totalizând o masă patru unități mai mici. Putem reprezenta prima lege a radioactivității cu următoarea ecuație generică:
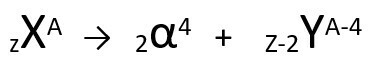
Ecuația generică a primei legi a radioactivității.
Să vedem un exemplu:
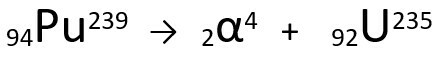
Ecuație reprezentând emisia de particule α de către Plutonium-239.
Rețineți că, atunci când emite o radiație alfa, atomul nou format, Uranium-235, are o masă cu patru unități mai mică și numărul atomic cu două unități mai mic - exact valorile corespunzătoare particulei α emise de nucleul plutoniu. Pentru a afla mai multe despre, accesați: Prima lege a radioactivității sau prima lege a lui Soddy.
A doua lege a radioactivității
A doua lege vorbește despre problema beta. Când un atom emite o particulă beta, formată dintr-un electron și cu o masă neglijabilă, masă atomică rămâne neschimbat este al tau numărul atomic crește o unitate. În mod generic, reprezentăm după cum urmează:
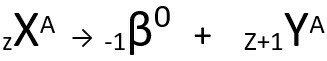
Ecuația generică a celei de-a doua legi a radioactivității.
Vezi exemplul:
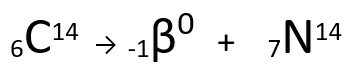
Ecuație reprezentând emisia de particule β de către Carbon-14.
Se poate observa că atomul de azot format are aceeași masă ca atomul C-14, adică sunt izobare, iar numărul său atomic crește cu o unitate. Creșterea în numar atomica fost explicat de savant Henrico Fermi, care a propus ca unul dintre neutroni a nucleului suferă o transmutație, conform următoarei ecuații, generând Aelectron(particula beta emisă), A neutrino(o particulă subatomică fără sarcină electrică și fără masă) și A proton(P).
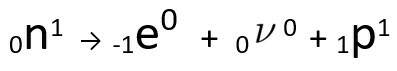
Ecuația reprezentând transmutația neutronică, conform ipotezei lui Fermi.
O electron este neutrino sunt emise către în afara nucleului, rămas numai protonul, ceea ce explică creșterea numărului atomic. Pentru a afla mai multe despre acesta, accesați: A doua lege a radioactivității sau a doua lege a Soddy.
Citește și: Diferența dintre contaminarea radioactivă și iradiere
aplicații
in ciuda vedere negativă depozitul pe radioactivitate are aplicații importante în viața noastră de zi cu zi, de exemplu, în producție de electricitateîn centrale nucleare prin fisiunea atomilor radioactivi.
În prezent, Brazilia nu folosește energie nucleară ca sursă principală de energie, dar are centrale nucleare (Angra 1 și 2) care lucrează pentru a furniza energie electrică țării. Putem menționa și întâlniri materiale găsit de arheologi folosind carbon-14.

Centrala nucleară din Rio de Janeiro, Brazilia
Un alt rol fundamental pe care îl joacă radioactivitatea este legat de domeniul medicinei, cum ar fi raze Xși în CT scaneazăși, de asemenea, în unele tipuri de tratament pentru cancer.
Citește și tu: Principalele riscuri ale producerii de energie nucleară pentru mediu
radioactivitate naturală
zilnic suntem expus cantități mici de radiații, fie că sunt artificiale sau naturale. Radioactivitatea naturală apare spontan în natură. O parte din această radiație pe care o primim provine din alimentele consumate zilnic, cum ar fi Radon-226 și Potasiu-40, care sunt prezentate în niveluri foarte scăzute și nu prezintă riscuri asupra sănătății noastre sau afectează valorile nutriționale ale alimentelor.
Acest proces de expunere a alimentelor la emisiile radioactive este destinat conserva alimentele și promovează o creșterea plantei. Câteva exemple de alimente care emit radiații sunt: nuci braziliene, banană, fasole, carne roșie, printre altele.
Descoperire
Studiul radioactivității a început cu cercetarea fizicianului german Wilhelm Röentgen, în 1895, când investiga efectulluminescență. Un alt om de știință important pentru dezvoltarea radioactivității a fost fizicianul francez Antoine-Henri Becquerel, care a observat, în 1896, marcaje făcute pe un film fotografic de o probă de sare de uraniu.
Cu toate acestea, a fost Cuplu curie care a folosit termenul de radioactivitate pentru prima dată. În 1898, lustruirea Marie Curie a continuat studii privind radioactivitatea și a făcut descoperiri valoroase pentru zonă, cum ar fi descoperirea a două elemente radioactive noi: poloniul (Po) și radiul (Ra).
Posterior, Ernest Rutherford a descoperit radiația de tip alfa (α) și beta (β), care a permis explicații mai bune pentru modelul său atomic, precum și avansarea cercetărilor legate de radioactivitate.
Citește și:Marie Curie: biografie, contribuții și moștenire
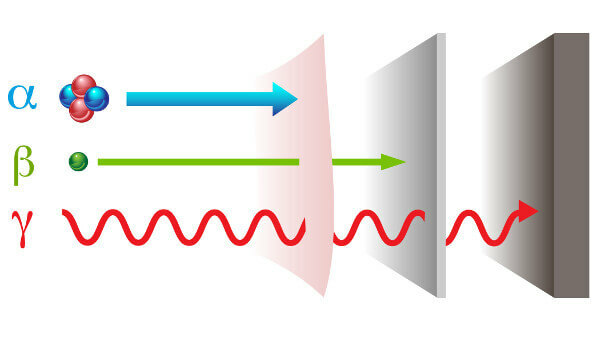
Tipuri de radiații și puterile lor de penetrare.
descompunere
O dezintegrarea radioactivă (sau transmutație) este proces natural unde unul nucleu instabil emite radiații, succesiv, pentru a scade-ți energia și să devină stabil.
Acest lucru se întâmplă în mod normal cu atomii de număr atomic. mai mare de 84, care sunt atomi cu instabilitate mare nuclear datorită cantității de încărcare pozitivă (protoni) acumulată în nucleu. În acest proces, neutronii nu sunt suficienți pentru a stabiliza toți protonii grupați în nucleu și apoi nucleul începe să sufere dezintegrare radioactivă până când numărul său atomic este mai mic de 84.
În unele cazuri, se poate întâmpla ca atomii cu un număr atomic mai mic de 84 să aibă nuclei instabili și, de asemenea trece prin procesul de descompunere, dar pentru asta trebuie să aibă un număr de protoni cu mult peste numărul de neutroni.
Dezintegrarea radioactivă este calculat prin timpul de înjumătățire (sau perioada de semi-dezintegrare, P) a radioizotop, care este timpul necesar pentru ca jumătate din masa probei radioactive inițiale să se dezintegreze, adică să devină stabilă. Grafic vorbind, conceptul de timp de înjumătățire este reprezentat mai jos. Pentru că este un proces continuu, curba tinde să ajungă zero.
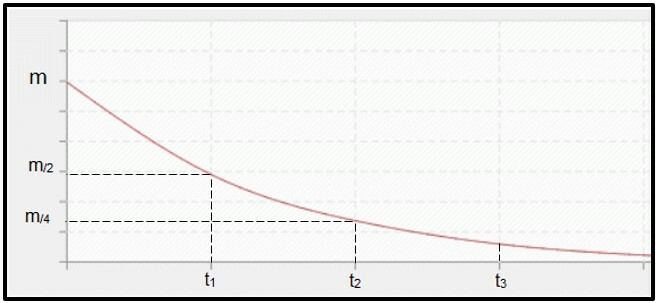
Grafic care reprezintă timpul de înjumătățire.
Calculele care implică dezintegrarea radioactivă urmează următoarele formule:
Formula pentru calcularea masei rămase după timpul de înjumătățire:
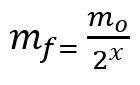
mf - masa finală
mO - masa inițială
x - cantitatea de înjumătățiri trecute
Formula pentru calcularea timpului de dezintegrare a unei probe radioactive:
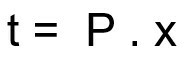
t - timpul de dezintegrare
P - perioada de înjumătățire
x - cantitatea de înjumătățiri trecute
elemente radioactive
Există două tipuri de elemente radioactive: tu natural si artificial. Cele naturale au elemente găsite în natură, deja cu nucleele lor instabile, cum ar fi uraniu, O actiniu este radio. Cele artificiale sunt produse de procese care destabilizează nucleul unui atom. În acest caz, putem menționa astatine este francium.
Principalele elemente radioactive sunt: uraniu-235, cobalt-60, stronțiu-90, radiu-224 și iod-131. Datorită utilizării sale pe scară largă în centralele nucleare și a tratamentelor pentru cancer, aceste elemente tind să apară mai frecvent în viața noastră de zi cu zi. Pentru a afla mai multe despre acest subiect, accesați: elemente radioactive.
Coș de gunoi radioactiv
Deșeuri radioactive sau deșeuri nucleare este reziduu din industrii care utilizează material radioactiv în procesele lor care nu mai au aplicații practice. Acest gunoi provine în principal din centrale nucleare este din aplicații medicale.
Producția mare de deșeuri radioactive a fost o problemă de mediu pentru întreaga lume, datorită insuficienței și insuficienței condiții de eliminare și depozitare.
Aceste steriluri sunt asociate cu contaminarea solului, a căilor navigabile și a aerului, rezultând distrugerea mediului treptat. În plus, acestea prezintă și riscuri pentru sănătatea umană, cum ar fi infecții, cancer și, în cazurile mai severe de contaminare, acestea pot duce la moarte.
exerciții rezolvate
(PUC-Camp-SP) Bomba atomică, numită și bombă nucleară, are atomi de uraniu-235 ca constituent fisibil, , emițătoare de particule alfa
, emițătoare de particule alfa  . Fiecare atom de U-235, atunci când emite o particulă alfa, este transformat într-un alt element, al cărui număr atomic este egal cu
. Fiecare atom de U-235, atunci când emite o particulă alfa, este transformat într-un alt element, al cărui număr atomic este egal cu
a) 231.
b) 233.
c) 234.
d) 88.
e) 90.
Șablon: Când un atom emite o particulă alfa, există o scădere de două unități în numărul atomic, conform primei legi a radioactivității. Prin urmare: 92-2 = 90. Litera e.
(PUC-Camp-SP) Iod-125, o varietate radioactivă de iod cu aplicații medicinale, are un timp de înjumătățire de 60 de zile. Câte grame de Iod-125 vor mai rămâne după șase luni, pe baza unei probe care conține 2,00 g de radioizotop?
a) 1,50
b) 0,75
c) 0,66
d) 0,25
e) 0,10
Șablon: În primul rând, se calculează numărul de înjumătățiri trecute pe parcursul celor 180 de zile:
t = P. X
180 = 60. X
x = 3
După ce se găsește numărul de înjumătățiri trecute, se calculează masa care va rămâne la sfârșitul celor 180 de zile:
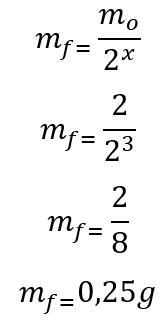
Prin urmare, 0,25g de radioizotop de Iod-135 vor rămâne la sfârșitul celor șase luni. Litera D.
De Victor Felix
Absolvent în chimie