Așa cum se arată în texte "Spectrul electromagnetic al elementelor chimice" și "Spectre de emisie și absorbție și legile lui Kirchhoff”, Spectrele de emisie discontinue ale fiecărui element chimic sunt diferite.

Deci, mai jos avem spectrele distincte ale unora dintre aceste elemente:

Astfel, fizicianul danez Niels Böhr (1885-1962) a realizat că acest lucru ar putea fi legat de structura atomului fiecăruia dintre aceste elemente. Deci, el a propus un model atomic care să completeze modelul lui Rutherford, dar s-a concentrat pe comportamentul electronilor din jur în nucleul atomului.
Cu ceva timp mai devreme, Max Planck (1858-1947) propusese o teorie că electronii sunt cuantificat, în sensul că ei emit și absorb cantități specifice de energie, ca și cum ar fi pachete mici de energie, pe care l-a numit cât costă (cuantic, la singular).
Astfel, Böhr a propus următoarele: întrucât fiecare element are un spectru diferit, fiecare element are în atom electroni cu energii constante și diferite de la element la element.
Fiecare electron poate rămâne doar pe o anumită orbită specifică, deoarece în fiecare dintre aceste orbite electronul are o energie constantă, bine definită și caracteristică. Electronul poate ocupa doar nivelurile de energie pentru care are energia respectivă.
Spectrele sunt discontinue deoarece electronii sunt cuantizați.
Un electron poate schimba nivelurile numai dacă absoarbe energie. De exemplu, atunci când ardeți o sare de sodiu într-un arzător Bunsen, furnizați energie electronilor. Atunci când absorb o cantitate de energie, electronul sare la un alt nivel mai energetic, rămânând în starea excitată. Cu toate acestea, starea fundamentală este mai stabilă, deci acest electron emite energia absorbită și revine pe orbita sa originală. Emite această energie sub formă de unde electromagnetice care pot fi vizualizate sub formă de lumină. În cazul sodiului, această lumină este de culoare galben intens. Astfel, atunci când aceste unde trec printr-o prismă, se obține spectrul discontinuu de sodiu.
Deci, pentru Böhr, fiecare linie luminoasă care a apărut în spectrul discontinuu al elementelor a indicat energia eliberată când electronul s-a întors de la un nivel exterior la unul mai aproape de nucleu.
Figura de mai jos vă ajută să înțelegeți mai bine această problemă:
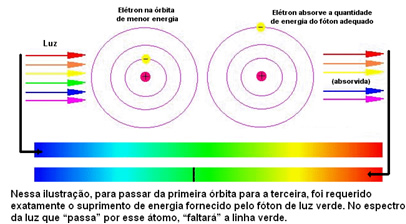
Deoarece atomilor fiecărui element li se permit doar anumite valori energetice care corespund straturilor de energie, pentru fiecare element există un spectru diferit.
De Jennifer Fogaça
Absolvent în chimie
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/quimica/espectros-eletromagneticos-estrutura-atomo.htm