Când supunem elemente diferite acțiunii unei flăcări, observăm că fiecare emite o culoare diferită. De exemplu, dacă ardem un stronțiu, o sodiu și o sare de cupru, vom vedea, respectiv, culorile roșu, galben intens și verde, așa cum se arată în figura următoare:

Dacă lumina acestor flăcări cade pe o prismă, a spectru discontinuu, adică, doar câteva linii luminoase colorate vor fi observate intercalate cu regiuni fără lumină. Pentru fiecare element, vom avea un spectru diferit.

Aceste tipuri de spectre sunt numite spectru de emisii, deoarece au fost emise de un anumit element și servesc la identificarea acestuia.
Este posibil să se obțină spectre de acest fel prin intermediul unui fascicul de lumină produs într-un tub electric de descărcare la mare temperaturi și presiuni scăzute, conținând gaze de la anumite elemente, cum ar fi hidrogen, sau ca gaze nobile muget:

Prin trecerea acestei radiații electromagnetice (lumină) produse printr-o prismă, se obțin spectrele de emisie ale fiecăruia dintre aceste elemente.
Anterior, se credea că spectrul solar realizat era total continuu, dar omul de știință englez William Hyde Wollaston a constatat că, prin lucrând cu un fascicul de lumină foarte îngust, cu o fantă de aproximativ 0,01 mm, ați putut vedea că spectrul solar conținea șapte linii negre despre. Mai târziu, tânărul Joseph Fraunhofer (1787-1826), folosind prisme și grătare de difracție, au descoperit că spectrul solar conține de fapt mii de linii negre suprapuse.
Ceva mai târziu, fizicul Gustav Robert Kirchhoff a observat că petele galbene, realizate de spectrul de sodiu, se aflau exact în același loc cu două linii negre din spectrul Soarelui. el și chimistul Robert Wilhelm Bunsen a efectuat mai multe experimente și a observat că dacă o lumină albă de pe arzătorul Bunsen, cum ar fi lumina soarelui, trecea pe lângă lumina galbenă emisă de sodiu și prisma era traversată pentru a genera spectrul; rezultatul ar fi un spectru solar continuu, în culori curcubeu, dar cu liniile negre (numite linii D de Fraunhofer) în aceeași poziție ca liniile galbene din spectrul de sodiu.
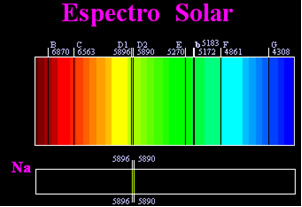
Soarele emite lumină de toate culorile, de la roșu la violet, totuși, când trece prin atmosfera Pământului, gazele prezente absorb lumina Soarelui exact în culorile pe care le emit.
Aceste tipuri de spectre sunt numite spectre de absorbție.
Pe baza acestor observații, Kirchoff a creat trei legile pentru spectroscopie, care sunt:
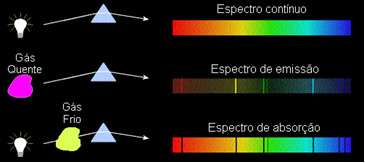
1) Un corp opac fierbinte, în oricare dintre cele trei stări fizice, emite un spectru continuu.
2) Un gaz transparent - ca cele ale gazelor nobile pe care le-am văzut mai sus - produce o spectru de emisii, cu aspect de linii luminos. Numărul și poziția acestor linii vor fi determinate de elementele chimice prezente în gaz.
3) Dacă a spectrul continuu trece printr-un gaz la temperatura cea mai scăzută, gazul rece determină prezența linii întunecate, adică a spectru de absorbție. Așa s-a întâmplat cu spectrul luminii solare care trece prin gazul de sodiu. În acest caz, numărul și poziția liniilor în spectrul de absorbție depind, de asemenea, de elementele chimice prezente în gaz.
De Jennifer Fogaça
Absolvent în chimie
Sursă: Școala din Brazilia - https://brasilescola.uol.com.br/quimica/espectros-emissao-absorcao-leis-kirchhoff.htm
