TEN Teoria oktetów stwierdza, że aby atom pierwiastka chemicznego był stabilny, musi uzyskać konfigurację elektronową gazu szlachetnego, to znaczy musi mieć osiem elektronów w powłoce walencyjnej lub dwa elektrony, jeśli atom ma tylko pierwszą powłokę elektronową. (K).
Beryl ma liczbę atomową równą 4. Dlatego twój atom ma 4 elektrony, a jego rozkład elektronowy w stanie podstawowym jest określony wzorem:

Konfiguracja elektroniczna berylu
Oznacza to, że beryl ma w swojej ostatniej powłoce 2 elektrony, należące do rodziny 2A (metale ziem alkalicznych). Miałby więc tendencję do oddawania tych dwóch elektronów, uzyskując ładunek 2+, czyli miałby tendencję do tworzenia wiązań jonowych.
Jednak obserwuje się, że atomy berylu wykonują wiązania kowalencyjne, z dzieleniem elektronów, jak pokazano w związku utworzonym poniżej, wodorku berylu (BeH2):
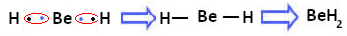
Tworzenie wiązań kowalencyjnych berylu z wodorem
Zauważ, że w tym przypadku beryl jest stabilny z mniej niż ośmioma elektronami w powłoce walencyjnej, ponieważ dzielą swoje elektrony jak atomy wodoru, teraz ma cztery elektrony w swoim ostatnim warstwa. Jest to zatem a
wyjątek od reguły oktetu.Ale wiązanie kowalencyjne zwykle występuje, ponieważ pierwiastek ma niekompletne orbitale. Na przykład, jak pokazano poniżej, wodór ma niepełny orbital, więc tworzy tylko jedno wiązanie kowalencyjne. Tlen ma dwa niekompletne orbitale i tworzy dwa wiązania kowalencyjne. Z kolei azot ma trzy niekompletne orbitale i w konsekwencji tworzy trzy wiązania kowalencyjne:
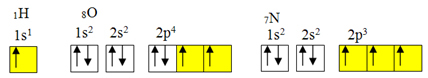
Elektroniczne dystrybucje wodoru, tlenu i azotu
Jednak, jak już pokazano, beryl nie ma niekompletnych orbitali.
Teraz nie przestawaj... Po reklamie jest więcej ;)
Dlaczego więc tworzy wiązania kowalencyjne?
Wyjaśnienie znajduje się w teoria hybrydyzacji, który mówi, że kiedy elektron z orbity otrzymuje energię, „przeskakuje” do najbardziej zewnętrznego pustego orbitalu, przebywanie w stanie wzbudzonym, a tym samym następuje fuzja lub mieszanie niekompletnych orbitali atomowych, generowanie orbitale hybrydowe które są sobie równoważne i różnią się od oryginalnych czystych orbitali.
Na przykład w przypadku berylu elektron z podpoziomu 2s otrzymuje energię i przechodzi na pusty orbital podpoziomu 2p:

Stan wzbudzony berylu do tworzenia orbitali hybrydowych
W ten sposób beryl ma dwa niekompletne orbitale, zdolne do tworzenia dwóch wiązań kowalencyjnych.
Zauważ, że jeden orbital jest na podpoziomie „s”, a drugi na „p”, więc wiązania, które beryl wykonałby, powinny być inne. Jednak tak się nie dzieje, ponieważ ze zjawiskiem hybrydyzacja, te niekompletne orbitale, które powstały, mieszają się, tworząc dwa orbitale zwane hybrydy lub zhybrydyzowany, które są sobie równe. Ponadto, ponieważ te dwa orbitale hybrydowe pochodzą z orbitalu „s” i orbitali „p”, mówimy, że ta hybrydyzacja jest typu sp:

Powstawanie hybrydyzacji berylu sp sp
Ponieważ orbitale hybrydowe są takie same, wiązania kowalencyjne, które tworzy beryl z atomami wodoru, również będą takie same:

Wzajemne przenikanie hybrydowych orbitali berylowych z orbitalami s wodorów
Zauważ, że następnie tworzy dwa wiązania sigma, które są typu s-sp (σs-sp).
Jennifer Fogaça
Absolwent chemii
