Teoria Hybrydyzacji pojawiła się jako uzupełnienie Teoria oktetów, udało się wyjaśnić strukturę większej liczby cząsteczek, w tym cząsteczek tworzonych przez bor (B).
Ten element ma pięć elektronów stanu podstawowego o następującej konfiguracji elektronicznej:
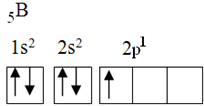
Według teorii oktetów bor mógł tworzyć tylko jedno wiązanie kowalencyjne, ponieważ ma tylko jeden niekompletny orbital atomowy. Jednak eksperymentalnie zauważa się, że pierwiastek ten tworzy związki, w których wykonuje więcej niż jedno wiązanie.
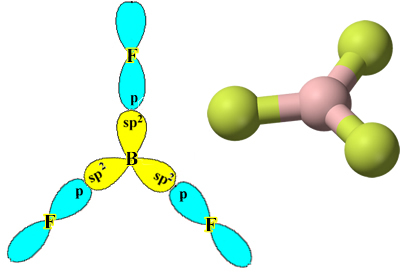
Przykładem jest trifluorek boru (BF3). Jak pokazano poniżej, bor tworzy trzy wiązania kowalencyjne z fluorem, dzieląc trzy pary elektronów i mający sześć elektronów w swojej ostatniej powłoce (warstwie walencyjnej), czyli wyjątek od reguły oktet.
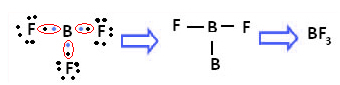
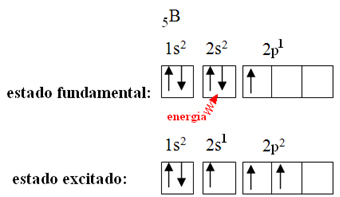
Wyjaśnia to zjawisko hybrydyzacji, które występuje z borem. Okazuje się, że elektron z podpoziomu 2s pochłania energię i przechodzi w stan wzbudzony, w którym wskakuje na pustą orbitę podpoziomu 2p. W ten sposób powstają trzy niekompletne orbitale, które mogą teraz tworzyć trzy wiązania kowalencyjne:
Jednak wiązania utworzone w trifluorku boru są takie same, ale jeśli spojrzymy powyżej, są dwa wiązania różne, gdyż jeden z nich byłby wykonany za pomocą orbitalu s, a dwa pozostałe za pomocą orbitalu tego typu. wpisz s. To tutaj zachodzi hybrydyzacja, to znaczy niekompletne orbitale łączą się, dając początek trzem orbitale hybrydowe lub zhybrydyzowany, które są identyczne i różnią się od oryginałów:
Teraz nie przestawaj... Po reklamie jest więcej ;)
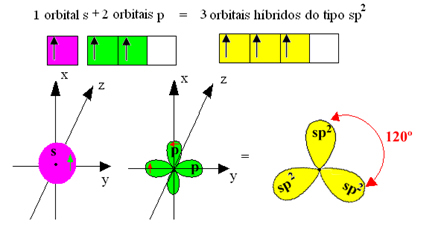
Ponieważ te orbitale hybrydowe składają się z jednego orbitali s i dwóch orbitali p, ta hybrydyzacja nazywa się hybrydyzacja sp².
Fluor, który wiąże się z borem, ma dziewięć elektronów. Jego rozkład elektroniczny i orbitale pokazano poniżej:
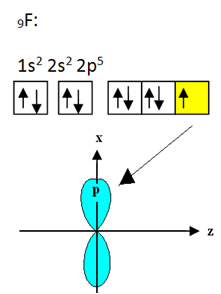
Zauważ, że każdy atom fluoru może tworzyć tylko jedno wiązanie kowalencyjne i że orbital, który tworzy to wiązanie, jest typu p. Tak więc obserwuj poniżej, jak powstają orbitale podczas tworzenia połączeń, które tworzą BF3 i zobacz, jak linki są identyczne, jak σp-sp2:
Dzieje się tak również z innymi elementami, zobacz na przykład tekst „Hybrydyzacja berylu”.
Jennifer Fogaça
Absolwent chemii
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
FOGAÇA, Jennifer Rocha Vargas. „Hybrydyzacja boru”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/hibridizacao-boro.htm. Dostęp 28 czerwca 2021 r.