Zwykle reakcje elektroliza wodna i elektroliza magmowa są przeprowadzane za pomocą elektrod grafitowych i platynowych, które nie biorą udziału w reakcji; przewodzą tylko prąd elektryczny. Istnieją jednak szczególne przypadki, w których konieczne jest użycie elektrody aktywne, czyli ulegające redukcji i utlenianiu.
Główne przypadki użycia tych elektrod, które uczestniczą w procesie redoks to: a elektrolityczne oczyszczanie metalitakie jak cynk, kobalt, nikiel, a zwłaszcza miedź; a także galwanotechnika. Zobaczmy, jak wygląda każdy przypadek:
• Oczyszczanie elektrolityczne miedzi: ta elektrolityczna rafinacja miedzi może wytworzyć czystość około 99,9% i jest używana głównie do produkcji druty miedziane, które przy najmniejszym zanieczyszczeniu mogą mieć zdolność przewodzenia bardzo prądu elektrycznego zmniejszyła się.
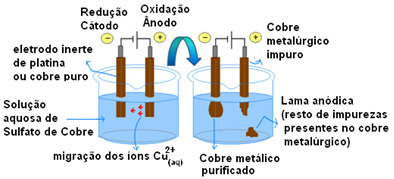
Obserwuj, jak przebiega ten proces, oglądając poniższy schemat kadzi elektrolitycznej:

Potencjalną różnicę stosuje się do wodnego roztworu siarczanu miedzi (CuSo4(aq)) – który przewodzi prąd – tak, że anoda będąca nieczystą metaliczną miedzią traci elektrony, czyli ulega utlenianiu, uwalniając swoje kationy (Cu
2+), które są osadzone na płycie ujemnej. Może to być obojętna płyta platynowa lub, lepiej, płyta z czystej miedzi. Stanowi katodę, która jest redukowana, gdy osadza się w niej miedź. Zatem półreakcje zachodzące w elektrodach to:Teraz nie przestawaj... Po reklamie jest więcej ;)
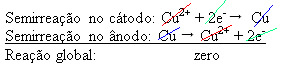
Fakt, że dał wynik zerowy wskazuje, że nie było żadnej reakcji chemicznej, a jedynie transport miedzi. Na dnie pojemnika znajdują się inne zanieczyszczone substancje zawarte w miedzi, takie jak złoto, srebro, krzemionka (piasek) i inne minerały, które można nawet sprzedać.
• Galwanotechnika: powłoka metaliczna jest nakładana na materiał, który ma być chroniony przed korozją.
Metal wybrany do powłoki - może to być chrom (chromowanie), nikiel (niklowanie), srebro (srebrzenie), złoto (złocenie) lub cynk (galwanizacja) – będzie anoda, elektroda dodatnia, która ulega utlenianiu, tracąc elektrony. Ulega utlenianiu w miejsce zabezpieczonego materiału, ponieważ jego potencjał redukcyjny jest większy.
Elektroda ujemna, czyli katoda, która odbiera te elektrony i ulega redukcji, jest samym materiałem, który został pokryty. W ten sposób pozostaje chroniony, nawet jeśli jego powierzchnia zostanie w jakiś sposób naruszona.
Jennifer Fogaça
Absolwent chemii
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
FOGAÇA, Jennifer Rocha Vargas. „Elektroliza z aktywnymi elektrodami”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/eletrolise-com-eletrodos-ativos.htm. Dostęp 28 czerwca 2021 r.