TEN równanie Clapeyrona to wyrażenie matematyczne, które wiąże wielkości, takie jak nacisk (P), objętość (V), temperatura (T) i liczba cząstek (n), które składają się na a gaz doskonały lub idealny. To równanie nosi imię francuskiego fizyka PawełemileClapeyron i może być rozumiany jako uogólnienie praw empirycznych gazyidealnywGay-Lussac, Charles i Boyle. Było to fundamentalne dla badania gazów doskonałych i umożliwiło ewolucję Maszyny termiczne, czyniąc je coraz bardziej wydajnymi w ciągu ostatnich kilku dekad.
Zobacz też: Fizyczne odkrycia, które zdarzyły się przez wypadek
Równanie Clapeyrona: równanie gazu doskonałego
Równanie Clapeyrona to wywodzi się z trzech praw empirycznychczyli prawa, które zostały ustalone na podstawie eksperymentów. Takie prawa wyjaśniają zachowanie gazów w przemiany gazoweizowolumetryczny (prawo Gay-Lussaca), izobaryczny (prawo Karola) i izotermy (Prawo Boyle'a). Zgodnie z tymi przepisami:
w przemianach izowolumetryczny, stosunek ciśnienia do temperatury termodynamicznej gazu doskonałego pozostaje stały;
w przemianach izobaryczny, stosunek objętości do temperatury termodynamicznej gazu doskonałego jest stały;
- w przemianach izotermy, iloczyn ciśnienia i objętości gazu doskonałego pozostaje stały.
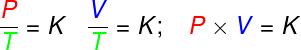
P – ciśnienie (Pa – paskal)
V – objętość gazu (m³)
T – termodynamiczna temperatura gazu (K – kelwin)
Z trzech powyższych praw równanie Clapeyrona określa, jaką wartość ma to stały (K) uzyskane w każdej z ww. transformacji. Zgodnie z równaniem Clapeyrona ta stała jest równa liczbie moli pomnożonej przez a stała R, znany jako uniwersalna stała gazów doskonałych i równa Stała Boltzmanna pomnożone przez Numer Avogadro.
Formuła
Sprawdź formułę znaną jako równaniewClapeyrona:
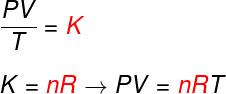
Nie – liczba moli (mol)
R – uniwersalna stała gazów doskonałych (R = 0,082 atm.l/mol. K lub 8,314 J.mol/K)
Analizując równanie Clapeyrona, można zauważyć, że nacisk wywierany przez idealne gazy jest wprost proporcjonalna do temperatury a także do liczba moli. Ponadto, ciśnienie jest odwrotnie proporcjonalne do objętości zajęty przez gaz.
O idealny model gazu możliwe dzięki równaniu Clapeyrona jest szeroko stosowane dla rozwój maszyn napędzanych przez płyny, takich jak maszyny parowe i silniki spalinowe.
Kilka ważnych wyników można uzyskać z równania Clapeyrona. Jeden z nich przewiduje na przykład, że 1 mol dowolnego gazu doskonałego zajmuje objętość 22,4 litra pod wpływem ciśnienia 1 atm (1,01.105 Pa) i w temperaturze 273K (0°C).
Zobacz też: Najważniejsze pojęcia w termologii
Rozwiązane ćwiczenia z równania Clapeyrona
Pytanie 1 – (UECE) Gaz, którego temperatura, objętość i ciśnienie mogą być powiązane z PV = nRT, ma następującą charakterystykę:
a) bardzo duża średnia odległość między cząsteczkami w celu pominięcia oddziaływań międzycząsteczkowych, z wyjątkiem zderzeń; cząsteczki ulegają zderzeniom elastycznym.
b) bardzo mała średnia odległość między cząsteczkami; cząsteczki ulegają zderzeniom nieelastycznym.
c) bardzo duża średnia odległość między cząsteczkami w celu pominięcia oddziaływań międzycząsteczkowych, z wyjątkiem zderzeń; cząsteczki ulegają zderzeniom nieelastycznym.
d) bardzo duża średnia odległość między cząsteczkami i silnymi oddziaływaniami międzycząsteczkowymi; cząsteczki ulegają zderzeniom elastycznym.
Rozkład:
W modelu gazu idealnego duża liczba bezwymiarowych cząstek porusza się z dużą prędkością w losowych kierunkach. Jedyną interakcją, której doświadczają te cząstki, są zderzenia doskonale sprężyste, więc właściwą alternatywą jest litera a.
Pytanie 2 —(UFRGS) Rozważ następujące stwierdzenia dotyczące gazów doskonałych.
JA. Stała R występująca w równaniu stanu dla gazów pV = nRT ma taką samą wartość dla wszystkich gazów doskonałych.
II. Równe objętości różnych gazów doskonałych, w tej samej temperaturze i ciśnieniu, zawierają tę samą liczbę cząsteczek.
III. Średnia energia kinetyczna cząsteczek gazu doskonałego jest wprost proporcjonalna do bezwzględnej temperatury gazu.
Które z nich są poprawne?
a) Tylko ja
b) Tylko II
c) Tylko III
d) Tylko I i II
e) I, II i III
Szablon:
Spójrzmy na alternatywy:
JA. poprawny, stąd nazywa się ją uniwersalną stałą gazów doskonałych.
II. poprawny. Zgodnie z równaniem Clapeyrona, jeśli dwa gazy idealne mają takie samo ciśnienie, temperaturę i objętość, to liczba cząstek w tych gazach jest równa.
III. poprawny. Zgodnie z twierdzeniem o ekwipartycji energii energia kinetyczna cząstek w gazie doskonałym jest proporcjonalna do jego temperatury.
Dlatego właściwą alternatywą jest litera e.
Pytanie 3 - (UFJF) Ludzie tacy jak Clapeyron, Boyle, Mariotte, Gay-Lussac, van der Walls, między innymi, opracowali ważne badania dotyczące właściwości gazów. Zachowanie gazów rzeczywistych jest zbliżone do gazów idealnych w warunkach niskiego ciśnienia, jak również do gazów zawartych w dużej objętości i gazów utrzymywanych w wysokich temperaturach. Weź pod uwagę, że w eksperymencie laboratoryjnym pojemnik o objętości V jest całkowicie zamknięty i zawiera 1 mol gazu doskonałego pod ciśnieniem 4,0 atm podlega rozprężaniu w stałej temperaturze równej 127 ° C, a zachowanie tego gazu jest zachowaniem gazu doskonałego, jak pokazano na graficzny.
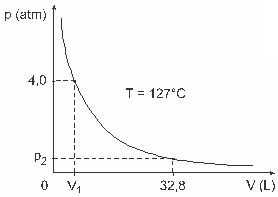
W tym przypadku, gdy gaz zajmuje objętość równą 32,8 L, wywierane przez niego ciśnienie będzie wynosić:
(Biorąc pod uwagę: uniwersalna stała gazów doskonałych wynosi R = 0,082 atm. l/mol. K.)
a) 0,32 atm
b) 0,40 atm
c) 1,0 atm
d) 2,0 atm
e) 2,6 atm
Rozkład:
Litera C.
Aby rozwiązać ćwiczenie, musimy zastosować dane do równania Clapeyrona, ale wcześniej musimy przekształcić temperaturę w stopniach Celsjusza na kelwiny. Sprawdzić:

Rafael Hellerbock
Nauczyciel fizyki
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/fisica/a-equacao-clapeyron.htm



