O pH roztworu wskazuje zawartość (pomiar) jonów hydroniowych (H3O+) obecny w środku. Ta zawartość decyduje o tym, czy analizowany roztwór ma charakter kwasowy, zasadowy czy obojętny.
Obserwacja: Warto zauważyć, że zawartość hydronu (H3O+ lub H+) można uzyskać po prostu w laboratorium za pomocą taśm wskaźnikowych pH - które jednak nie mają dużej dokładności w miarze - lub za pomocą sprzętu zwanego pegometrem, który, wręcz przeciwnie, ma dużą dokładność w pomiarze pH rozwiązanie.
Krokomierz lub potencjometr do pomiaru pH roztworu
Aby przeprowadzić obliczenia z udziałem pH rozwiązania, możemy użyć następującego równania logarytmicznego:
pH = - log [H3O+]
lub
pH = - log [H+]
WAŻNY: W obliczeniach dotyczących pH roztworu zawsze używamy logarytmu o podstawie 10.
Mapa myśli: obliczanie PH rozwiązań

* Aby pobrać mapę myśli w formacie PDF, Kliknij tutaj!
Z powyższego równania logarytmicznego nadal możemy zastosować następujące uproszczenie (otrzymane przez zastosowanie funkcji logarytmicznej) tego równania:
[H3O+] = 10-pH
Obserwacja: Powyższe uproszczone wyrażenie może być użyte tylko wtedy, gdy wartość pH jest liczbą całkowitą; w przeciwnym razie należy użyć funkcji logarytmicznej.
Należy podkreślić, że obliczenia dotyczące pH roztworu są zawsze związane z pOH (potencjał hydroksylowy / OH-), ponieważ obie moce są oparte na samojonizacji wody (Kw = 10-14, zjawisko, w którym woda wytwarza tak dużo H+ ile oh-) i prawo rozcieńczenia Ostwalda (im bardziej rozcieńczony roztwór, tym większa ilość kationów H+ ). A zatem:
o autojonizacja wody:
Kw = [H+]. [O-], więc pH + pOH = 14
prawo Rozcieńczenie Ostwalda(Dzięki niemu możemy dowiedzieć się, jak bardzo dany materiał jonizuje lub dysocjuje w wodzie):
Kja = M.α2
Ki = stała jonizacji substancji w środowisku wodnym;
M = molarność lub stężenie molowe substancji w środowisku wodnym;
α2 = stopień jonizacji lub dysocjacji materiału w medium.
Klasyfikacja roztworu jako kwaśnego, zasadowego lub obojętnego będzie miała następujące kryteria (a 25 ODO):
-
jeden rozwiązanie będzie neutralne gdy stężenie H+ jest równy stężeniu OH- lub mają pH równe 7.
Teraz nie przestawaj... Po reklamie jest więcej ;)
[H+] = [OH-]
jeden roztwór będzie kwaśny gdy stężenie H+ jest większe niż stężenie OH- lub pH wynosi od 0 do 7.
[H+] > [OH-]
jeden rozwiązanie będzie podstawowe gdy stężenie H+ jest mniejsza niż stężenie OH- lub pH wynosi od 7 do 14.
[H+] < [OH-]
Zobacz kilka przykładów obliczeń dotyczących pH roztworów:
1º)Wiedząc, że stężenie hydronu w kawie wynosi 1,10-5, jakie będzie pH obecne w tym roztworze?
jak ćwiczyć pod warunkiem stężenia hydroniowego na kawę możemy we użyj uproszczonej formuły pH:
[H3O+] = 10-pH
1.10-5 = 10-pH
10-5 = 10-pH
-5 = -pH
pH = 5
Ponieważ pH jest mniejsze niż 7, roztwór jest kwaśny.
2º) (UFU) Jakie jest pH roztworu kwasu octowego 0,045 mol/L, zakładając jego Kja = 1,.10-5? Dane: log 2 = 0,3; log 3 = 0,48.
Dane ćwiczeń:
M = 0,045 mol/L
Kja = 1,8.10-5
log 2 = 0,3
log 3 = 0,48
W jaki sposób ćwiczenie zapewniło molarność (M) i stała jonizacji (Kja),wstępnie określmy stopień jonizacji wspomnianego kwasu, ponieważ stężenie hydronu (H3O+ lub H+) jest zawsze wynikiem mnożenia między molowością a stopniem jonizacji. Wkrótce:
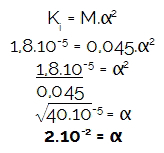
Następnie obliczmy ilość mnożącej się molarności hydroniowej kwasu według stwierdzonego stopnia jonizacji:
[H3O+] = M.α
[H3O+] = 0,045.2.10-2
[H3O+] = 0,09.10-4
[H3O+] = 9.10-4 mol/L
Na koniec umieszczamy wartość stężenia hydroniowego w logarytmicznym równaniu pH:
pH = - log [H3O+]
pH = - log 9,10-4
pH = 4 - log 9
pH = 4-log 32
pH = 4 - 2. (dziennik 3)
pH = 4- (2.0.48)
pH = 4-0,96
pH = 3,04
Ponieważ pH jest mniejsze niż 7, roztwór jest kwaśny.
3º)(Cefet-PR) A 45 OC, Kw roztworu obojętnego wynosi 4,10-4. Jaka jest więc wartość pH tego roztworu w tej temperaturze? Dane dziennika 2 = 0,3.
Jak ćwiczenie mówi, że rozwiązanie jest? neutralny, wkrótce [H3O+] jest równe [OH-]:

Na koniec umieszczamy wartość stężenia hydroniowego w logarytmicznym równaniu pH:
pH = - log [H+]
pH = - log 2,10-7
pH = 7 - log 2
pH = 7-0,3
pH = 6,7
Ponieważ pH wynosi prawie 7, roztwór jest neutralny (jak wskazano w ćwiczeniu), ponieważ temperatura wynosi 45 ODO.
Przeze mnie Diogo Lopes Dias
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
DNI, Diogo Lopes. „Obliczenia dotyczące pH roztworów”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/calculos-envolvendo-ph-solucoes.htm. Dostęp 28 czerwca 2021 r.
Prawo Ostwalda, stała jonizacji, stężenie molowe, stopień jonizacji, słaby elektrolit, liczba mol jonizowanych, Friedrich Wilhelm Ostwald, monokwasy, monozasady.