Zgodnie z pierwszą zasadą termodynamiki w każdym procesie termodynamicznym ilość ciepła Q otrzymana przez system jest równa wykonanej przez niego pracy plus zmienność jego energii wewnętrznej.
Przy stałym ciśnieniu ciepło wymieniane przez układ z czynnikiem zewnętrznym jest wykorzystywane do pracy i zmiany energii wewnętrznej. W wielu praktycznych sytuacjach układy poddawane są działaniu ciśnienia atmosferycznego, jak w przypadku reakcji chemicznej. Powyższy rysunek przedstawia schemat PV tego typu procesu.
W tym przypadku w równaniu Pierwszego Prawa
Q=τ+∆U
żaden z warunków nie jest zerem. Praca jest napisana w funkcji zmian objętości V, takich jak:
τ=P.∆V
W szczególnym przypadku idealnego gazu jednoatomowego energię można zapisać w następujący sposób:

Dlatego możemy napisać pierwszą zasadę termodynamiki jako funkcję ΔV:


Ciepło wymieniane z medium wynosi (5/2)P.ΔV, a 40% całości – co odpowiada P.ΔV – jest wykorzystywane do wykonywania pracy; i (3/2)P.ΔV, co odpowiada 60% całości, są wykorzystywane do zmiany energii wewnętrznej. Ten wynik jest ważny dla idealnego gazu jednoatomowego.
Ciepło jest związane ze zmianą temperatury (przy użyciu równania gazu doskonałego) poprzez:
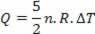
W ten sposób dostarczone ciepło można obliczyć na podstawie zmiany temperatury lub zmiany objętości.
Autor: Domitiano Marques
Ukończył fizykę
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/fisica/primeira-lei-para-processos-isobaricos.htm


