TEN warstwa ozonowa, jak sama nazwa wskazuje, jest warstwą lub powłoką utworzoną przez cząsteczki gazu ozonowego (O3(g)), alotropowa forma tlenu, której cząsteczka jest pokazana poniżej:
Znajduje się w warstwie poza atmosferą, na wysokości między 20 a 35 km, nazywana stratosfera. Ale ten gaz można znaleźć również w mniejszych ilościach w troposferze (wysokość około 10 km).

Warstwa ozonowa odgrywa istotną rolę w utrzymaniu życia na Ziemi, ponieważ jest w stanie wchłonąć do 99% promieniowanie ultrafioletowe (UV) ze Słońca. Ponieważ promieniowanie to ma krótkie długości fal i wysoką energię, ma dużą siłę przenikania przez skórę. To właśnie to promieniowanie powoduje opaleniznę, ale jest też odpowiedzialne za wiele szkodliwych skutków, ponieważ może uszkadzać DNA (kwas dezoksyrybonukleinowy), powodując mutacje genetyczne.
Promieniowanie UV dzieli się na trzy wyraźne zakresy energii: UVA (320 nm do 400 nm), UVB (290 nm do 320 nm) i UVC (200 nm do 290 nm). Wśród nich najbardziej szkodliwe i energetyczne jest promieniowanie UVC, które na szczęście nie dociera do powierzchni ziemi, ponieważ jest filtrowane przez warstwę. ozonu.
Tak więc warstwa ozonowa jest naprawdę wszechstronną i skuteczną osłoną, która pomaga chronić przed tym szkodliwym promieniowaniem. wiele form życia, takich jak plankton, które są odpowiedzialne za produkcję dużej części naszego tlen.
Ilość ozonu w stratosferze nie jest stała, ale jest wprost proporcjonalna do natężenia promieniowania UV. Powstawanie cząsteczek tego gazu następuje poprzez rozkład cząsteczek tlenu (O2(g)), tworząc wolny tlen, który w drugim etapie reaguje z gazowym tlenem:
1. krok:2(g) → 2 O(sol)
II etap: The(sol) + O2(g) → 13(g)
W warstwie ozonowej tworzy się wówczas równowaga chemiczna:
2 O2(g) 1 O3(g) + O(sol) ∆H = + 142,35 kJ/mol
Niestety, z biegiem czasu ludzie uwolnili pewne zanieczyszczające związki, które przesunęły tę równowagę w kierunku rozkładu ozon, zmniejszając jego koncentrację w stratosferze i pozostawiając planetę bardziej bez ochrony.
Jedna z największych przyczyn niszczenia warstwy Ozon to CFC (chlorofluorowęglowodory, znane również jako Fréons®), które są związkami utworzonymi przez atomy węgla, fluor i chlor. CFC są uwalniane do atmosfery głównie dzięki ich zastosowaniu jako propelent w aerozolu (spraye), w lodówkach i lodówkach, jako środek rozszerzający do tworzyw sztucznych oraz w rozpuszczalnikach do czyszczenia obwodów elektronicznych.

Jak widać z poniższych reakcji, kiedy CFC uderza w stratosferę, promieniowanie słoneczne rozbija jego cząsteczki, uwalniając chlor. Z kolei chlor reaguje z ozonem, co zmniejsza jego stężenie:
CH3DOℓ(sol) → CH3(sol)+DOℓ(sol)
DOℓ(sol) + O3(g) → CℓO(sol) + O2(g)
Ponadto CℓPowstały reaguje również z wolnymi atomami tlenu w atmosferze, uwalniając więcej atomów chloru, który będzie reagował z ozonem, coraz bardziej niszcząc naszą warstwę ochronną:
ClO(sol) + O(sol) → Cl(sol) + O2(g)
Najbardziej dotkniętym miejscem jest Antarktyda, gdzie we wrześniu 2000 roku dziura w warstwie ozonowej była dwukrotnie większa niż w Europie. Satelita monitorujący ozon NASA zarejestrował największa dziura, jaką kiedykolwiek widziano nad Antarktydą, mierząca około 28,3 miliona kilometrów kwadratowych, co stanowi ponad trzykrotność powierzchni Australii. Sytuacja ta jest gorsza na Antarktydzie, ponieważ tam powstawanie atomów chloru jest bardzo duże i pozostaje niezmienione, ze względu na nietypowe chmury stratosferyczne powstały podczas zimy australijskiej i to na powierzchni cząstek tych chmur zachodzą reakcje pokazane.
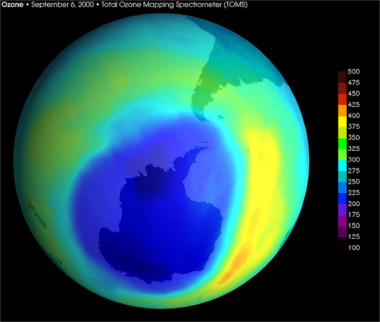
Zdjęcie satelitarne NASA „dziury” w warstwie ozonowej nad Antarktydą, wrzesień 2000
Możliwe konsekwencje zniszczenia warstwy ozonowej to:wzrost zachorowalności na raka skóry, w wyniku działania promieni ultrafioletowych i nasilenia globalnego ocieplenia, co prowadzi do różnych katastrofalnych skutków, takich jak topnienie lodowców polarnych, podnoszenie poziomu wody w oceany.
Ale wciąż jest iskierka nadziei, od 2000 roku stężenia wCFC spadają o prawie jeden procent rocznie.
Jennifer Fogaça
Absolwent chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/camada-de-ozonio2.htm

