Aby zaszła reakcja chemiczna konieczne jest spełnienie czterech podstawowych warunków, którymi są:
1. Odczynniki muszą się skontaktować;
2. Między odczynnikami musi być powinowactwo chemiczne;
3. Zderzenia między cząstkami odczynnika muszą być skuteczne;
4. Musi zostać osiągnięta energia aktywacji.
Pokrótce zobacz każdy przypadek:
1.Kontakt między odczynnikami:
Warunek ten jest oczywisty, bo nawet jeśli reagenty mają do siebie duże powinowactwo, jak w przypadku kwasów i zasad, jeśli zostaną rozdzielone, reakcja nie nastąpi. Muszą wejść w kontakt, aby ich cząstki mogły się zderzyć, rozrywając wiązania reagentów i tworząc wiązania produktów.

2.Powinowactwo chemiczne:
Jak widzieliśmy, kontakt odczynników jest konieczny, ale niewystarczający. Na przykład, jeśli włożymy sód do kontaktu z wodą, nastąpi niezwykle gwałtowna reakcja, ale jeśli włożymy złoto, nie zobaczymy żadnej różnicy. Dzieje się tak, ponieważ różne substancje mają ze sobą różne powinowactwa chemiczne lub mogą w ogóle nie mieć żadnego powinowactwa. Im większe powinowactwo chemiczne, tym szybsza reakcja.
We wspomnianych przykładach sód ma duże powinowactwo z wodą, do tego stopnia, że metaliczny sód jest przechowywany w nafcie, aby nie wchodzić w kontakt z wilgocią z powietrza. Złoto jest obojętne, dlatego złote pomniki trwają tak długo, jak egipskie sarkofagi.

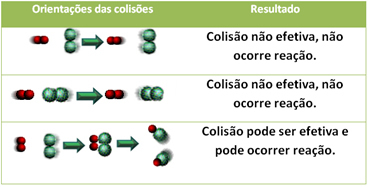
3.Teoria kolizji:
Nawet w związkach, które mają powinowactwo chemiczne, aby reakcja mogła zajść, konieczne jest skuteczne zderzenie ich cząstek, atomów lub cząsteczek. Nie wszystkie cząstki, które się zderzają, robią to skutecznie, ale wstrząsy, które powodują zerwanie wiązania odczynnikowe i tworzenie nowych wiązań to te, które występują w prawidłowej orientacji i z energią dość.
Poniżej pokazano przypadek dwóch zderzeń nieskutecznych i jednego zderzenia efektywnego, które skutkuje zajściem reakcji.
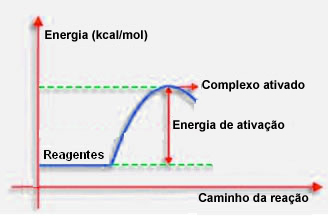
4.Energia aktywacji i aktywowany kompleks:
Jak wspomniano w poprzednim punkcie, skuteczna kolizja, oprócz korzystnego prowadzenia, wymaga również wystarczającej energii. Minimalna ilość energii potrzebna do zajścia każdej reakcji nazywana jest energią aktywacji.
Jeśli reagenty mają energię równą lub większą niż energia aktywacji, podczas dobrze zorientowanego szoku, utworzy się początkowo aktywowany kompleks, który jest strukturą pośrednią między reagentami a produkty. W aktywowanym kompleksie powstają osłabione wiązania odczynnikowe i powstają wiązania nowego produktu.
Tak więc energia aktywacji działa jako rodzaj bariery dla zajścia reakcji, ponieważ im jest większa, tym trudniej będzie zajść reakcja. W niektórych przypadkach konieczne jest doprowadzenie energii do odczynników. Na przykład gaz do gotowania ma powinowactwo do interakcji z tlenem w powietrzu, ale musimy dostarczyć energię, gdy łączymy zapałkę, w przeciwnym razie reakcja nie zachodzi. Ale po rozpoczęciu, sama reakcja uwalnia wystarczającą ilość energii, aby aktywować inne cząsteczki i podtrzymać reakcję.
Jennifer Fogaça
Absolwent chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/condicoes-para-ocorrencia-reacoes-quimicas.htm
