W wiązania chemiczne to interakcje, które zachodzą między atomami, aby stać się cząsteczką lub podstawową substancją związku. Istnieją trzy rodzaje linków: kowalencyjny, metaliczny i joński. Atomy, tworząc wiązanie chemiczne, starają się stabilizować elektronicznie. Ten proces jest wyjaśniony przez teoria oktetów, który mówi, że każdy atom, aby osiągnąć stabilność, musi mieć osiem elektronów w swojej powłoce walencyjnej.
Wiązania chemiczne i reguła oktetu
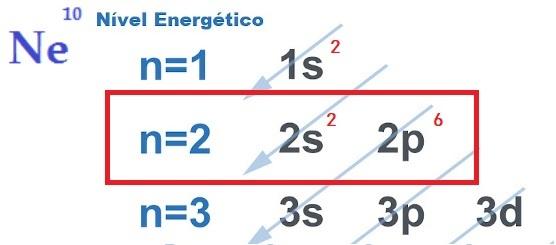
TEN poszukiwanie stabilności elektronicznej, co uzasadnia realizację wiązań chemicznych między atomami, tłumaczy się teoria oktetów. Zaproponowana przez Newtona Lewisa teoria ta stwierdza, że oddziaływanie atomowe zachodzi tak, że każdy pierwiastek uzyskuje stabilność gazu szlachetnego, to znaczy osiem elektronów w warstwa walencyjna.
W tym celu element dawać, otrzymywać lub udostępniać elektrony z zewnętrznej powłoki, tworząc w ten sposób wiązania chemiczne o charakterze jonowym, kowalencyjnym lub metalicznym. ty Gazy szlachetne są jedynymi atomami, które mają już osiem elektronów w swojej zewnętrznej powłoce i dlatego nie reagują zbyt mocno z innymi pierwiastkami.
Popatrzrównież: Zasady dystrybucji elektronicznej: jak to zrobić?
Rodzaje wiązań chemicznych
Aby uzyskać osiem elektronów w powłoce walencyjnej, jak przewidziano w regule oktetu, atomy łączą się ze sobą, które różnią się w zależności od potrzeby oddania, otrzymywania lub udostępniania elektronów, a także charakteru atomów wiążących.
wiązania jonowe
Znany również jako wiązania elektrowalentne lub heteropolarne, zdarzyło się pomiędzy metale oraz pierwiastki bardzo elektroujemne (ametale i wodór). W tego typu wezwaniu metale mają tendencję do utraty elektronów, przekształcanie w kationy (jony dodatnie), a niemetale i wodór zyskują elektrony, stają się anionami (jony ujemne).
ty Związki jonowe są twarde i kruche, mają wysoką temperaturę wrzenia i przewodzą prąd elektryczny gdy są w stanie ciekłym lub rozcieńczone w wodzie.
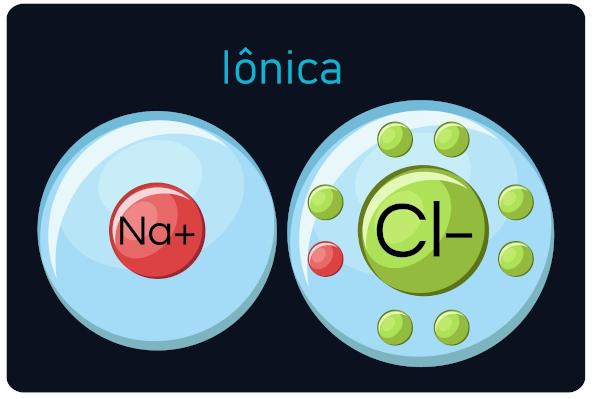
Obserwacja: Pamiętaj, że atom, który zyskuje elektrony, stanie się jonem o znaku ujemnym, a atom, który traci elektrony, stanie się znakiem dodatnim.
Przykłady substancji jonowych:
- Wodorowęglan (HCO3-);
- amon (NH4+);
- Siarczan (SO4-).
Aby dowiedzieć się więcej na temat tego typu wiązania chemicznego, odwiedź nasz tekst: wiązania jonowe.
wiązania kowalencyjne
W wiązania kowalencyjne stało się przez współdzielenie elektronów. Ze względu na niską różnicę elektroujemności między elementami wiążącymi nie oddają ani nie odbierają elektronów, ale udostępniać pary elektroniczne aby były stabilne zgodnie z regułą oktetu. Ten rodzaj połączenia jest bardzo powszechny w prostych elementach, takich jak Cl2, H2, O2, a także w łańcuchach węglowych. różnica elektroujemność pomiędzy ligandami określa, czy wiązanie jest polarne czy niepolarne.

Przeczytaj też:Polaryzacja cząsteczek: jak rozpoznać?
datywne wiązanie kowalencyjne
Nazywany również koordynacyjne wiązanie kowalencyjne, semipolarne, celownikowe lub koordynacyjne, jest bardzo podobny do wiązania kowalencyjnego, różnica między nimi polega na tym, że jeden z atomów w wiązaniu celownikowym jest odpowiedzialny za dzielenie dwóch elektronów. W tego typu połączeniu, że występuje sztuczniecząsteczka uzyskuje te same cechy, co cząsteczka w wyniku spontanicznego wiązania kowalencyjnego.
Metalowe linki
Ten rodzaj wiązania zachodzi między metalami, które obejmują pierwiastki z rodziny 1A (metale alkaliczne), 2A (metale ziem alkalicznych) oraz metale przejściowe (blok B układu okresowego - grupa 3 do 12), tworzące to, co nazywamy Stopy metali. Cechą różnicową w stosunku do innych typów połączeń jest ruch elektronów, co wyjaśnia fakt, że materiały metalowe w stanie stałym są doskonałymi przewodnikami elektrycznymi i cieplnymi. Ponadto stopy metali mają wysoką temperaturę topnienia i wrzenia, ciągliwość, ciągliwość i połysk. Przykładami stopów metali są:
stal: żelazo (Fe) i węgiel C;
brąz: miedź (Cu) + cyna (Sn);
mosiądz: miedź (Cu) + cynk (Zn);
złoto: złoto (Au) + miedź (Cu) lub srebro (Ag).

streszczenie
- Wiązania chemiczne: interakcja między atomami poszukującymi stabilności elektronowej.
- Rodzaje połączeń: jonowe, kowalencyjne i metaliczne.
- Reguła oktetu: definiuje, że aby atom był stabilny, musi mieć osiem elektronów w powłoce walencyjnej.
rozwiązane ćwiczenia
Pytanie 1 - (Mackenzie-SP) Aby atomy siarki i potasu uzyskały konfigurację elektronową równą gazowi szlachetnemu, konieczne jest, aby:
(Dane: liczba atomowa S = 16; K = 19).
a) siarka otrzymuje 2 elektrony, a potas 7 elektronów.
b) siarka daje 6 elektronów, a potas 7 elektronów.
c) siarka daje 2 elektrony, a potas 1 elektron.
d) siarka otrzymuje 6 elektronów, a potas oddaje 1 elektron.
e) siarka otrzymuje 2 elektrony, a potas oddaje 1 elektron.
Rozkład
Alternatywa E. Ponieważ siarka należy do rodziny 6A lub 16, zgodnie z zasadą oktetu, musi uzyskać 2 elektrony, aby mieć 8 w swojej powłoce walencyjnej. Natomiast potas, który należy do pierwszej rodziny układu okresowego pierwiastków (1A lub rodzina wodorowa), aby mieć w swojej warstwie walencyjnej konfigurację gazu szlachetnego, musi stracić 1 elektron. Łącząc 2 atomy potasu z 1 atomem siarki, możemy ustanowić wiązanie jonowe, w którym oba pierwiastki są stabilne elektrycznie.
pytanie 2 - (UFF) Mleko matki jest pokarmem bogatym w substancje organiczne, takie jak białka, tłuszcze i cukry oraz substancje mineralne, takie jak fosforan wapnia. Te związki organiczne mają jako główną cechę wiązania kowalencyjne w tworzeniu ich cząsteczek, podczas gdy minerał ma również wiązanie jonowe. Sprawdź alternatywę, która poprawnie przedstawia pojęcia odpowiednio wiązań kowalencyjnych i jonowych:
a) Wiązanie kowalencyjne występuje tylko w związkach organicznych.
b) Wiązanie kowalencyjne odbywa się przez przeniesienie elektronów, a wiązanie jonowe odbywa się przez współdzielenie elektronów o przeciwnych spinach.
c) Wiązanie kowalencyjne powstaje przez przyciąganie ładunków między atomami, a wiązanie jonowe przez rozdzielanie ładunków.
d) Wiązanie kowalencyjne powstaje przez łączenie atomów w cząsteczkach, a wiązanie jonowe przez łączenie atomów w kompleksy chemiczne.
e) Wiązanie kowalencyjne odbywa się przez współdzielenie elektronów, a wiązanie jonowe odbywa się przez przeniesienie elektronów.
Rozkład
Alternatywa E.
Spójrzmy na inne:
- Alternatywa dla: nieprawidłowe, ponieważ wiązania kowalencyjne występują również w związkach nieorganicznych, takich jak CO2.
- Alternatywa b: nieprawidłowa, ponieważ wiązania kowalencyjne powstają przez dzielenie, a wiązania jonowe przez przeniesienie elektronu.
- Alternatywa c: Zarówno wiązanie kowalencyjne, jak i wiązanie jonowe powstają z powodu konieczności utraty lub zyskania elektronów, a nie przez przyciąganie elektrostatyczne między jądrami.
- Alternatywa d: Oba wiązania, zarówno kowalencyjne, jak i jonowe, powstają poprzez połączenie atomów w cząsteczce.
pytanie 3 - (PUC-MG) Przejrzyj tabelę, która pokazuje właściwości trzech substancji, X, Y i Z, w warunkach otoczenia.
| Substancja | Temperatura topnienia (c°) | przewodnictwo elektryczne | Rozpuszczalność w wodzie |
| x | 146 | Żaden |
rozpuszczalny |
| tak | 1600 | wysoki | nierozpuszczalny |
| z | 800 | po prostu stopiony lub rozpuszczony w wodzie | rozpuszczalny |
Biorąc pod uwagę te informacje, PRAWIDŁOWE jest stwierdzenie, że substancje X, Y i Z to odpowiednio:
a) jonowy, metaliczny, molekularny.
b) molekularny, jonowy, metaliczny.
c) molekularny, metaliczny, jonowy.
d) jonowe, molekularne, metaliczne.
Rozkład
Alternatywa C.
Substancja X jest cząsteczkowa, jako wiązania molekularne, zwane również kowalencjami, mają niską temperaturę wrzenia, ponieważ różnica elektroujemności między ligandami nie jest bardzo wysoki. Ogólnie związki kowalencyjne nie mają przewodności elektrycznej, a rozpuszczalność jest zmienna.
Możemy rozpoznać substancję Y jako metaliczną, ponieważ metale mają wysoką temperaturę topnienia, są doskonałymi przewodnikami elektrycznymi i są nierozpuszczalne w wodzie.
Wreszcie substancja Z jest jonowa, ponieważ temperatura topnienia tej substancji jest stosunkowo wysoka, co jest konsekwencją krystalicznego ułożenia cząsteczki. Gdy substancja jonowa jest rozpuszczona w wodzie lub w stanie ciekłym, ma wolne jony, dzięki czemu przewodzi elektrony i jest rozpuszczalna w wodzie.
Laysa Bernardes Marques
Nauczyciel chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/ligacoes-quimicas.htm

