TEN stała hydrolizy (Kh) odnosi się do równowaga chemiczna powstały w wyniku hydrolizy soli (reakcja chemiczna z udziałem soli rozpuszczalnej i wody).
Jako stałą każdej innej równowagi wyrażenie stała hydrolizy składa się z iloczynu stężeń produktu podzielonego przez iloczyn stężeń reagentów w następujący sposób:
Kh = [produkty]
[odczynniki]
Praca ze stałą hydrolizy obejmuje znajomość trzech ważnych zjawisk:
- Dysocjacja soli;
- Jonizacja wody;
- Hydroliza soli.
Dysocjacja soli
Po dodaniu rozpuszczalnej soli do wody dysocjuje i uwalnia kation inny niż hydroniowy (H+) i anion inny niż hydroksylowy (OH-).

Aby przypomnieć, kiedy sól jest lub nie jest rozpuszczalna w wodzie, Kliknij tutaj i przestudiuj tabelę rozpuszczalności soli.
jonizacja wody
Woda jest substancją, która w naturalny sposób ulega samojonizacji, czyli wytwarza kation hydroniowy i anion hydroksylowy.
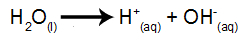
równanie jonizacji wody
hydroliza soli
Jako sól rozpuszczalna uwalnia jony do wody, a woda ulega jonizacji, wytwarzając jony w środku może zachodzić reakcja (hydroliza) między jonami soli i jonami wody. Kiedy ta reakcja wystąpi, możliwe interakcje to:
- Kation soli z anionem wody (tworzenie zasady);
- Anion soli z kationem wody (tworzenie soli);
Powyższe interakcje wystąpią tylko wtedy, gdy utworzona zasada lub kwas są słabe.
Zobacz przykład hydrolizy soli:
→ Hydroliza podchlorynu amonu (NH4ClO)
Po dodaniu podchlorynu amonu do wody rozpuszcza się i dysocjuje, uwalniając jony kationu amonu (NH4+) i anion podchlorynu (ClO-):

Równanie przedstawiające jony uwolnione w wyniku dysocjacji podchlorynu amonu
Ponieważ woda poddając się jonizacji wytwarza H+ i OH-, mamy w roztworze dwa kationy i dwa aniony, które mogą reagować. Kation NH4+ reaguje tylko z anionem OH-, ponieważ tworzy słabą zasadę (NH4OH). Anion ClO- reaguje tylko z kationem H+, ponieważ tworzy słaby kwas (HClO).

Równanie równowagi hydrolizy podchlorynu amonu
Konstrukcja wyrażenia stałej hydrolizy
Konstrukcja stałej hydrolizy soli zależy wyłącznie od równania hydrolizy dla tej soli. Na przykład hydroliza podchlorynu amonu, nad którą pracowaliśmy w poprzednim punkcie, dała następujące równanie:

Równanie równowagi hydrolizy podchlorynu amonu
Jak zbudować ekspresję stała hydrolizy uwzględnia produkty i odczynniki, wyrażenie stałej byłoby następujące:
Kh = [HClO].[NH4OH]
[ClO-].[NH4+]
UWAGA: Woda nie bierze udziału w równaniu, ponieważ jest odczynnikiem płynnym, a także dlatego, że jest podstawowym środkiem zachodzenia hydrolizy, czyli jest stała.
Przeze mnie Diogo Lopes Dias
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-constante-hidrolise.htm
