Aby zrozumieć, dlaczego drewno, które palimy, nie topi się, najpierw przypomnijmy sobie, czym jest stopiona substancja, to znaczy jest w stanie płynnym.
Różnica między stanem stałym, ciekłym i gazowym występuje tylko w stanie skupienia cząstek. W trzech stanach substancja składa się z tych samych cząstek, ale między nimi jest mniej więcej przestrzeń.
W stanie stałym cząstki są bliżej siebie, bez dużej swobody ruchu. W stanie ciekłym cząstki mają większą swobodę i mogą się poruszać.
Okazuje się, że większość drewna (50%) składa się z celulozy, która w rzeczywistości jest polimerem. Polimer powstaje przez połączenie kilku cząsteczek, zwanych monomerami. W przypadku celulozy powstaje przez połączenie setek cząsteczek β-glukozy, jak pokazano poniżej. Celuloza ma wtedy wzór (C6H10O5)Nie i osiąga masy cząsteczkowe rzędu 400 000 u.
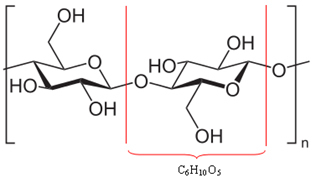
Ponieważ są to ogromne molekuły, polimery tworzące drewno nie mogą się łatwo poruszać. Należy również zauważyć, że cząsteczki β-glukozy tworzące celulozę mają grupy hydroksylowe (─ OH). Grupy te wiążą ze sobą wodór, który jest najbardziej intensywnym rodzajem oddziaływania międzycząsteczkowego, utrzymując ściśle ze sobą polimer.

Wiązania wodorowe między cząsteczkami tworzącymi polimer celulozy*
A zatem, aby zerwać te więzy, musielibyśmy włożyć w system tyle energii, że drewno rozkłada się jeszcze przed stopieniem i nie jest już drewnem.
Tak więc drewno podczas spalania przechodzi reakcję chemiczną, która jest czymś więcej niż zwykłą zmianą stanu fizycznego. Jego cząsteczki rozpadają się i łączą z tlenem obecnym w powietrzu, tworząc nowe substancje, takie jak gaz węglowy i woda.

* Źródło i autor obrazu: laghi.l.
Jennifer Fogaça
Absolwent chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/por-que-madeira-nao-derrete.htm