ty metale są to pierwiastki chemiczne, których główną cechą fizyczną jest zdolność do utraty elektronów, a w konsekwencji do tworzenia kationów metali. Z tego powodu mogą tworzyć dwa rodzaje wiązań chemicznych: wiązanie jonowe i wiązanie metaliczne.
TEN wiązanie jonowe występuje, gdy metal wchodzi w interakcję z elementem o charakterze metalicznym, który może być ametal lub wodór. W tym typie wiązania mamy do czynienia z utratą elektronów przez metale i pozyskiwaniem elektronów przez niemetale lub wodór.
już wiązanie metaliczne ustala się między atomami pojedynczego pierwiastka metalicznego. Ten rodzaj wiązania występuje tylko między atomami jednego metalu i wyłącznie dlatego, że metal nie może ustanowić wiązania chemicznego z innym innym pierwiastkiem metalicznym.
Ogólna charakterystyka metali
Ciała stałe w temperaturze pokojowej, z wyjątkiem rtęci;
Są genialne;
Mają wysoką temperaturę topnienia i wrzenia;
Zazwyczaj są koloru srebrnego, z wyjątkiem złota, które jest złote i miedzi, które jest czerwonawe;
Czyste metale tworzą skupiska atomów (jednego pierwiastka chemicznego) zwane sieciami krystalicznymi.
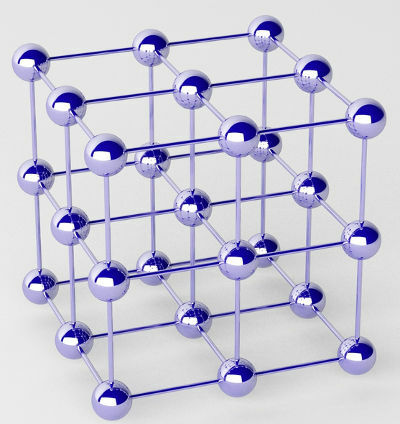
Reprezentacja sieci krystalicznej metalu
Zasady wiązania metalicznego
W wiązanie metaliczne, sieci krystaliczne, które tworzą metale, są w rzeczywistości klastrem jonowym (składającym się tylko z kationy i elektrony). Elektrony obecne w warstwie walencyjnej atomów metalu ulegają delokalizacji, to znaczy opuszczają warstwę walencyjną, powodując, że atom staje się kationem (z niedoborem elektronów).
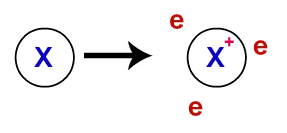
Reprezentacja zdelokalizowanych elektronów z powłoki walencyjnej
Po delokalizacji elektrony z atomów metalu zaczynają otaczać kationy, tworząc prawdziwe „morze elektronów”. Każdy z elektronów obecnych w tym morzu ma zdolność swobodnego poruszania się po sieci krystalicznej metalu.
Teraz nie przestawaj... Po reklamie jest więcej ;)

Reprezentacja modelu morza elektronowego
UWAGA: Elektrony „z morza” nie są w stanie opuścić sieci krystalicznej i przejść przez nią.
Właściwości metali uzasadnione wiązaniem metalicznym
a) Plastyczność
Dzięki metalowi można wytwarzać arkusze o różnych grubościach i arkuszach. To właśnie dzięki tej właściwości metali możemy budować różne przedmioty, takie jak noże, miecze itp.

Ostrze miecza wykonane jest z metalu
b) Przewodność
Ogólnie rzecz biorąc, metale są dobrymi przewodnikami prądu elektrycznego i ciepła. Kiedy jakikolwiek metal styka się ze źródłem ciepła lub źródłem prądu elektrycznego, jest w stanie je przewodzić.

Aluminiowa patelnia w płomieniu pieca nagrzewa się całkowicie z powodu przewodności.
c) Ciągliwość
Poprzez metal możemy produkować druty. Zastosowanie metalu w postaci drutów ułatwia jego użycie, zwłaszcza w odniesieniu do przewodności elektrycznej.

Do produkcji przewodów można użyć metalu, takiego jak miedź.
Przeze mnie Diogo Lopes Dias
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
DNI, Diogo Lopes. „Co to jest wiązanie metaliczne?”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ligacao-metalica.htm. Dostęp 27 czerwca 2021 r.
Chemia

Wiązanie jonowe, układy między związkami jonowymi, aglomeraty jonowe, chlorek sodu, sól kuchenna, substancja jonowa, siły przyciągania elektrostatycznego, aniony chlorkowe, kationy sodu, rozpuszczalniki polarne, jony dodatnie, kationy, jony ujemne, aniony.