W tekście "Tytuł lub procent masy” widzieliśmy, jak obliczyć zależność między masą substancji rozpuszczonej a masą roztworu, dla roztworów stałych, ciekłych i gazowych. W tym tekście zobaczymy jednak, że możliwe jest również obliczenie miana objętościowego dla roztworów ze składnikami ciekłymi lub gazowymi.

Tytuł w tomie można obliczyć za pomocą wyrażenia:
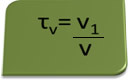
Rozważmy jako przykład wodny roztwór alkoholu etylowego stosowany jako środek antyseptyczny i dezynfekujący, który był przygotowany przez dodanie 70 ml czystego alkoholu do wystarczającej ilości wody, aby uzupełnić objętość 100 ml rozwiązanie. Więc mamy:
τ = 70 ml = 0,7
100ml
Tytuł możemy też wyrazić w procentach, po prostu mnożąc wynik przez 100%. Zatem w tym przypadku mamy 70% roztwór alkoholu etylowego, co oznacza, że na każde 100 jednostek objętości roztworu, 70 jednostek objętości to alkohol.
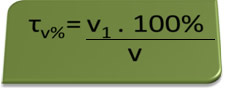
W poniższym przypadku mamy 70% roztwór alkoholu etylowego w 250 ml roztworu; co oznacza, że 175 ml to alkohol, zgodnie z obliczeniami:
100 ml 70 ml alkoholu
250 ml x
x = 70. 250
100
X = 175 ml alkoholu

Nie możemy jednak powiedzieć, że w tym przypadku mamy 75 ml (250-175) wody. W przeciwieństwie do miana masowego, w którym możemy dodać masę rozpuszczalnika do masy substancji rozpuszczonej, aby znaleźć masę roztworu, nie można tego zrobić w odniesieniu do miana objętościowego.

Oznacza to, że objętość roztworu nie jest równa sumie objętości rozpuszczalnika i objętości substancji rozpuszczonej (chociaż często różnicę można uznać za nieistotną). Dzieje się tak, ponieważ siły międzycząsteczkowe występujące w tych cieczach wpływają na końcową objętość.
W przypadku wyżej wymienionego roztworu, np. alkoholu etylowego, gdy mieszamy alkohol z wodą, następuje skurcz całkowitej objętości roztworu; oznacza to, że końcowa objętość będzie mniejsza, niż gdybyśmy dodali objętość samego alkoholu i wody. Dzieje się tak, ponieważ cząsteczki alkoholu tworzą wiązania lub wiązania wodorowe z cząsteczkami wody, zmniejszając przestrzenie między nimi.
Dlatego w tym i innych przypadkach objętość roztworu musi być zmierzona eksperymentalnie, jeśli nie została podana w ćwiczeniu.
Procent objętości jest szeroko stosowany w przypadku napojów alkoholowych i alkoholu komercyjnego, jak wspomniano powyżej. Zobacz dwa ważne zastosowania tego obliczenia:
- Alkomat: alkomat mierzy stężenie alkoholu etylowego we krwi, a w Brazylii obowiązuje zakaz prowadzenia pojazdów o zawartości alkoholu we krwi równej lub większej niż 0,1%. Osoba z taką zawartością alkoholu ma na każdy litr krwi 1 ml alkoholu, co pokazują następujące obliczenia:
τv%=V1. 100%
v
0,1 % = V1. 100%
1L
V1 = 0,1% → V1 = 0,001 l = 1 ml
100%

- Zawartość etanolu w benzynie: w Brazylii benzyna jest regulowana przez dodanie etanolu. Ale zawartość etanolu w benzynie musi wynosić co najwyżej 24% objętości bezwodnego alkoholu (ponieważ benzyna musi być bezwodna). Im więcej etanolu dodaje się do benzyny, tym jaśniejsze staje się paliwo i zwiększa się jego gęstość.
Jennifer Fogaça
Absolwent chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/titulo-volume-uma-solucao-quimica.htm

