sole nieorganiczne są tworzone przez połączenie jonowe co najmniej jednego kationu (utworzonego przez dowolny metal lub amon) i anionu (prostego lub związku).
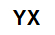
Ogólny wzór cząsteczkowy soli
Po dodaniu do wody sole dysocjują, uwalniając co najmniej jeden kation inny niż hydroniowy (H+) i anion inny niż wodorotlenek (OH-).
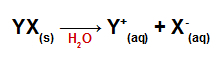
Równanie dysocjacji dla dowolnej soli
Klasyfikacja soli
Ogólnie rzecz biorąc, sole mogą mieć następujące klasyfikacje:
prosta sól: sól utworzona przez tylko jeden kation i jeden anion. Przykłady: NaCl, CaSO4, KCN, NH4WSPÓŁ3 itp.
Sól uwodorniona: ma dwa kationy (z których jeden musi być hydronium) i anion. Przykłady: NaHCO3, CaHBO3 itp.
Sól hydroksylowa: zawiera kation i dwa aniony (z których jeden musi być wodorotlenkiem). Przykłady: MgOHCl, Al(OH)2ClO3 itp.
Sól uwodniona: przedstawia cząsteczki wody związane z jej strukturą krystaliczną. Przykłady: CaCl2.2H2O, CuSO4.6H2itd.
Sól podwójna: ma dwa kationy (wszystkie inne niż hydronium) i jeden anion lub jeden kation i dwa aniony (wszystkie inne niż wodorotlenek). Przykłady: Typ4CN, AgFeBO3 itp.
Ałun: jest solą utworzoną przez dwa siarczany z kationami NOx równymi +1 i +3, plus 24 cząsteczki wody. Przykłady: Ag2TYLKO4.Glin2(TYLKO4)3.24H2na2TYLKO4.Sb2(TYLKO4)3.24H2O
Zasada nazewnictwa soli
Nazwa anionu + de + nazwa kationu
→ K3KURZ4
Sól zawiera anion fosforanowy (PO4-3) i kation potasu (K+1), stąd jego nazwa to fosforan potasu.
→ Przypadek3
Sól zawiera anion siarczynowy (SO3-2) i kation wapnia (Ca+2), stąd jego nazwa to siarczyn wapnia.
UWAGA: Jeżeli kationem nie jest srebro, cynk lub pierwiastek należący do rodzin IA, IIA i IIIA, to jego NOX należy podać cyfrą rzymską przed nazwą kationu.
→ Cu2TYLKO4
Sól zawiera anion siarczanowy (SO4-2) i kation wapnia (Cu+1), stąd jego nazwa to siarczan miedzi I.
Sól uwodorniona: Dla tej soli przed nazwą anionu należy wpisać przedrostek odnoszący się do ilości wodoru we wzorze. Ten przedrostek musi być oddzielony od słowa wodór przez myślnik.
→ NaHCO3
Sól ma anion wodorowy, węglanowy i kation sodu, dlatego jej nazwa to monowodorowęglan sodu.
Sól hydroksylowa: Dla tej soli przed nazwą anionu musimy wpisać przedrostek odnoszący się do ilości hydroksyli w formule. Ten przedrostek musi być oddzielony od słowa hydroksy przez myślnik.
→ Al(OH)2ClO3
Sól ma dwa hydroksyle, anion chloranowy i kation glinu, więc jej nazwa to dihydroksychloran glinu.
Sól uwodniona: Dla tej soli po nazwie kationu musimy wpisać przedrostek odnoszący się do ilości cząsteczek wody we wzorze. Ten przedrostek musi być oddzielony od słowa nawodniony przez myślnik.
→ CaCl2.2H2O
Sól ma dwie cząsteczki wody, anion chlorkowy i kation wapnia, dlatego jej nazwa to dwuwodzian chlorku wapnia.
Sól podwójna z dwoma kationami: Dla tej soli musimy wpisać podwójne słowo w nawiasach po nazwie anionu, a następnie najbardziej elektrododatnim kationie i drugim kationie.
→ AgFeBO3
Ta sól zawiera srebro (kation bardziej elektrododatni) i kation żelaza II, oprócz anionu boranowego. Nazywa się boran (podwójny) srebra i żelaza II.
-
Sól podwójna z dwoma anionami:
Nazwa najbardziej elektroujemnego anionu + łącznik + nazwa najmniej elektroujemnego anionu + de + nazwa kationu
→ Rodzaj4CN
Ta sól zawiera kation tytanu IV, oprócz fosforanu (bardziej elektroujemny anion) i anion cyjankowy. Nazywa się fosforanem cyjanku tytanu IV.
Sól ałunowa: W przypadku tej soli ignorujemy ogólną zasadę. Wystarczy napisać termin ałun, po którym następuje nazwa kationu o ładunku +3 i nazwa kationu o ładunku +1, oddzielone spójnikiem e.
→ W2TYLKO4.Sb2(TYLKO4)3.24H2O
Sól ałunowa ma kation antymonu +3 i kation sodu +1, więc jej nazwa to ałun antymonu III i sód.
Właściwości fizyczne soli
Są stałe w temperaturze pokojowej;
Mają wysoką temperaturę topnienia i wrzenia;
Powstają z wiązań jonowych;
Przewodzą prąd elektryczny w stanie ciekłym (po przetopieniu) lub po rozpuszczeniu w wodzie;
Ogólnie rzecz biorąc, są one rozpuszczalne w wodzie, ale istnieją sole, które są uważane za praktycznie nierozpuszczalne.
Właściwości chemiczne soli
Sole to związki, które mają zdolność reagowania chemicznego (pod warunkiem, że nie mają tego samego kationu lub tego samego anionu co inna substancja) z kilkoma grupami substancji, a mianowicie:
W reakcji podwójnej wymiany z kwasem: tworzą nową sól i nowy kwas.
W reakcji podwójnej wymiany z zasadą: tworzą nową sól i nową zasadę.
W reakcja podwójnej wymiany z inną solą: tworzą dwie nowe sole.
Niektóre sole mają zdolność cierpienia rozkład pod wpływem ciepła, tworząc dwie lub więcej nowych substancji. Jeśli podgrzejemy wodorowęglan sodu (NaHCO3), na przykład ulegnie rozkładowi, tworząc węglan sodu (Na2WSPÓŁ3), woda (H2O) i dwutlenek węgla (CO2).
Przeze mnie Diogo Lopes Dias
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-sao-sais-inorganicos.htm

