Dysocjacja podstawy to jest proces fizyczny który występuje w tej ważnej grupie substancji nieorganicznych, gdy są one rozpuszczone w wodzie, lub kiedy przechodzą przez proces stapiania (przejście ze stanu stałego do stanu ciekłego poprzez ogrzewanie).
Ogólnie rzecz biorąc, zjawisko dysocjacja podstawowa jest to uwalnianie kationów i anionów, które tworzą związek jonowy, który w tym przypadku jest podstawą. Tak więc podczas dysocjacja podstawowa, Uwolnienie jony które już istnieją w związku, to znaczy nie tworzą się nowe jony.
Zasadę tworzy dowolny metal (X), który jest kationem związku, lub kation amonowy (grupa NH4+), związany z anionem wodorotlenkowym (reprezentowanym przez grupę OH), jak w poniższych przedstawieniach:
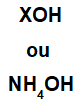
Ogólne reprezentacje formuły bazowej
forma reprezentować dysocjacja podstawowa odbywa się to poprzez równanie, w którym w odczynniku mamy zasadę, aw produktach jony (kationy i aniony). Różnica polega na tym, jak przebiega dysocjacja:
Rozpuszczenie bazy w wodzie:
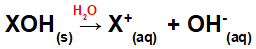
Równanie przedstawiające dysocjację zasady w środowisku wodnym
Dysocjacja przez fuzję bazy:
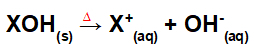
Równanie przedstawiające dysocjację bazy przez proces fuzji
Analizując powyższe ogólne równania, weryfikujemy, że we wszystkich z nich zawsze będziemy mieć bazę, kation (który jest metalem lub grupą NH4+) i anion (OH-). Ale czy oni wszyscy tacy są? Czy nie ma między nimi różnicy? Na pierwsze pytanie odpowiedź brzmi „nie”, a na drugie tak.
Kiedy przeprowadzamy dysocjacja od podstawy, fundamentalne jest najpierw przeanalizowanie wzoru bazowego, ponieważ z niego możemy określić obciążenie kationu i ilości molowej anionów wodorotlenowych, ponieważ ilość molowa kationu jest standardowa (zawsze 1 mol).
Warto pamiętać, że ilość grup OH obecnych we wzorze zasadowym determinuje ładunek kationu oraz ilość w molach anionu wodorotlenkowego w dysocjacji zasady.
Spójrzmy na przykłady wodorotlenku glinu [Al(OH)3] i wodorotlenek złota (AuOH). W formule na bazie glinu występują trzy grupy OH, a w formule na bazie złota tylko jedna grupa OH. Tak więc w dysocjacji tych zasad mamy:
Dysocjacja Al(OH)3:
Ponieważ ta zasada ma we wzorze trzy grupy OH, ładunek kationu będzie wynosił +3, a ilość anionów w molach równa się 3 molom, co widać w następującym równaniu:
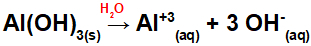
Równanie dysocjacji na bazie glinu w środowisku wodnym
Dysocjacja z AuOH:
Ponieważ ta zasada ma we wzorze grupę OH, ładunek kationu będzie wynosił +1, a ilość anionów w molach równa się 1 molowi, co widać w następującym równaniu:
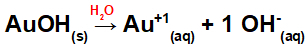
Równanie dysocjacji zasad ze złotem w środowisku wodnym
Przeze mnie Diogo Lopes Dias
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-dissociacao-das-bases.htm
