TEN elektroujemność jest to tendencja atomu do przyciągania elektronów do siebie, gdy jest połączony z innym pierwiastkiem chemicznym. poprzez wiązanie kowalencyjne, to znaczy, w którym elektrony są wspólne, uznając tę cząsteczkę za odosobniony.
Rozważmy dwa przykłady, aby lepiej zrozumieć zaprezentowaną koncepcję:
1. Przykład: Cząsteczka wodoru: H2 → H - H
Kiedy dwa atomy wodoru spotykają się, siły przyciągania między jądrami każdego z nich występują w tym samym czasie. jeden z tych atomów przez elektron drugiego atomu i siły odpychania między elektronami a jądrami dwóch atomy. Kiedy siły te osiągną równowagę, dwa elektrony znajdują się w obszarze elektrosfer, który znajduje się gdzieś pomiędzy nimi. atomy cząsteczki, w których oba oddziałują z dwoma elektronami, stając się stabilnymi, to znaczy, że oba atomy dzielą parę elektrony.
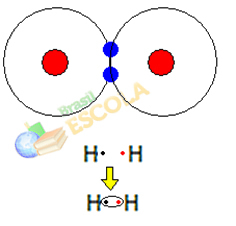
Jest to wiązanie kowalencyjne, które tworzy cząsteczkę. Ale ponieważ dwa atomy tej cząsteczki są dokładnie takie same, sposób, w jaki przyciągają do siebie elektrony, jest również taki sam. Więc mówimy, że
nie ma różnicy elektroujemności albo że ona to jest apolarne.Drugi przykład: Cząsteczka chlorowodoru: HCℓ
W tym przypadku dzielenie pary elektronów odbywa się między różnymi elementami, ponieważ w związku z tym atom chloru przyciąga elektrony z większą intensywnością niż wodór. Dlatego mówimy, że chlor jest bardziej elektroujemny niż wodór.
Jak pokazano na poniższym rysunku, ze względu na różnicę elektroujemności a dipol elektryczny (μ), które są dwoma monopolami elektrycznymi, przy czym elektrony są bardziej przyciągane do chloru. Zatem wiązanie H ─ Cℓ będzie miało częściowy ładunek ujemny na chlorze (δ-) i częściowy ładunek dodatni na wodorze (δ+). Więc to jest cząsteczka z różnicą elektroujemności i jest polarny:
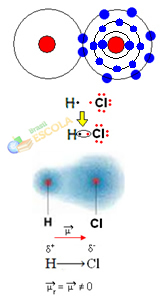
To pokazuje nam, że elektroujemność jest wielkością względną, a nie bezwzględną, ponieważ określa się ją, biorąc pod uwagę porównania sił wywieranych przez atomy w wiązaniu kowalencyjnym.
Istnieje kilka sposobów obliczania elektroujemności, ale najczęstszym jest skala elektroujemności zaproponowana przez Paulinga. Powiedzmy, że mamy ogólną cząsteczkę A B. Pauling zaproponował, że energia wiązania tej cząsteczki, symbolizowanej przez D, byłaby sumą średniej arytmetycznej energii wiązania (D) cząsteczek gazu tych dwóch atomów, to jest A-A i B-B, z kwadratem różnicy elektroujemności każdego atomu tej cząsteczki (xTEN i xb):
re(A-B) = [D(A-A) + D(NOCLEG ZE ŚNIADANIEM)]+k(xTEN - xb)2
Stała k w powyższym wzorze wynosi 96,5 kJ. molo-1. Pauling przypisał arbitralną wartość elektroujemności wodoru, która wynosiła 2,1 i w ten sposób można było odkryć wartość elektroujemności pozostałych pierwiastków w stosunku do on.
W oparciu o tę metodę podano wartości elektroujemności Paulinga dla pierwiastków układu okresowego, z wyjątkiem gazów szlachetnych.

Zauważ, że te wartości są właściwością okresową, ponieważ zmieniają się okresowo w zależności od liczby atomowej pierwiastków. Zobacz na przykład, że najbardziej elektroujemnymi pierwiastkami są te w prawym górnym rogu tabeli, czyli fluor (4,0) i tlen (3,5), a najmniej elektroujemne są te w lewym dolnym rogu, czyli fran (0,8) i cez (0,8).
Na tej podstawie stworzono nawet rząd elektroujemności najbardziej elektroujemnych pierwiastków, które pracują najczęściej:
F > O > N > Cℓ > Br > I > S > C > P > H
Zobacz wartości elektroujemności:
4,0 > 3,5 > 3,0 > 3,0 > 2,8 > 2,5 > 2,5 > 2,5 < 2,1
Istnieje pewien rodzaj „sztuczki”, aby ozdobić ten rząd elektroujemności, który jest podany w poniższym zdaniu, w którym inicjał każdego słowa odpowiada symbolowi danych elementów:
“facześć Onie mieć NO Clube, brmam jasAuć DOumierający Pdla Hszpital"
Więc możemy tak powiedzieć elektroujemność to właściwość okresowa, która wzrasta od lewej do prawej i od dołu do góry w układzie okresowym.

Wynika to z wielkości promienia atomowego. Im większy promień atomu, tym dalej wspólne elektrony znajdują się od jego jądra, a zatem słabsze przyciąganie między nimi. Prawdą jest również odwrotnie, im mniejszy promień atomu, tym bliżej elektrony będą do jądra i tym większe przyciąganie między nimi. Tak więc możemy stwierdzić, co następuje:
Elektroujemność wzrasta wraz ze zmniejszaniem się promienia atomowego.
Jennifer Fogaça
Absolwent chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/eletronegatividade.htm

