Możemy zauważyć, że ilekroć zwiększamy stężenie jednego lub wszystkich reagentów biorących udział w reakcji chemicznej, zwiększa się tempo jego rozwoju, to znaczy szybkość reakcji.
Prawdą jest również coś przeciwnego. Na przykład obecnie zaleca się stosowanie żelu alkoholowego zamiast zwykłego alkoholu, ponieważ istnieje mniejsze ryzyko jego spalenia, a tym samym uniknięcia wypadków. Zwykły alkohol w płynie jest w rzeczywistości mieszaniną alkoholu i wody, przy czym alkohol żelowy zawiera mniejszą ilość alkoholu. Dlatego też, gdy stężenie jednego z reagentów spalania jest zmniejszone, w przypadku alkoholu reakcja przebiega wolniej. Z drugiej strony, im czystszy alkohol, tym szybsza reakcja spalania.

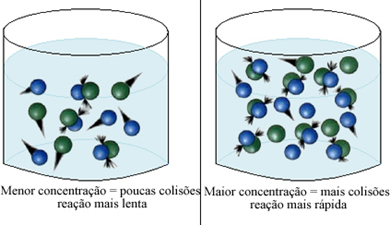
Jak stwierdzono w tekście Warunki występowania reakcji chemicznych, jednym z warunków zajścia reakcji jest skuteczna kolizja między cząstkami. A zatem, wzrost stężenia odczynników umożliwia zamknięcie większej ilości cząstek lub cząsteczek w tej samej przestrzeni. Zwiększa to liczbę kolizji między nimi, a także zwiększa prawdopodobieństwo wystąpienia skutecznych kolizji, które spowodują zajście reakcji. W rezultacie reakcja przebiega szybciej.
Aby to zobaczyć, pomyśl o następującym przykładzie: gdy mamy płonący żar i chcemy, aby to spalanie przebiegało szybciej, czy dmuchamy lub rozdmuchujemy żar? Dlaczego to działa?
Cóż, jednym z reagentów w tej reakcji spalania jest tlen w powietrzu. Podczas potrząsania prąd powietrza usuwa popiół powstający podczas spalania, co ułatwia kontakt tlenu z żarem. W ten sposób zwiększamy kontakt między reagentami i przyspieszamy reakcję spalania.
W skrócie mamy:

Podczas pracy z gazami jednym ze sposobów na zwiększenie stężenia reagentów jest: obniżyć ciśnienie. Kiedy to robimy, zmniejszamy objętość, a w konsekwencji zwiększamy stężenia odczynników.

Jennifer Fogaça
Absolwent chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/concentracao-dos-reagentes-velocidade-das-reacoes.htm
