O Schemat faz to wykres używany do wskazania warunków temperaturowych i nacisk potrzebne, aby uzyskać substancja w pewnym stan fizyczny (solidny, ciekły lub gazowe).
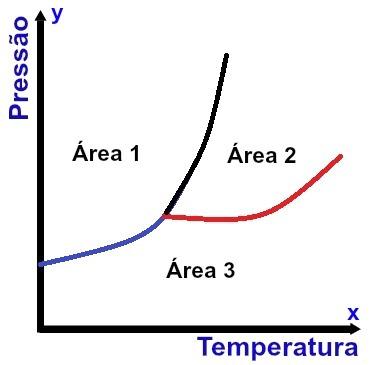
Reprezentacja diagramu fazowego
Oś x (pozioma) zawiera wartości temperatury, a oś y (pionowa) wartości ciśnienia. Ponadto istnieją trzy krzywe połączone z jednym punktem (zwanym potrójnym punktem), dzielące wykres na trzy dobrze zdefiniowane obszary, jak widać na powyższym schemacie.
Oprócz wskazania warunków, w których substancja ma być w określonym stanie fizycznym, Schemat faz wskazuje warunki, w których mogą wystąpić zmiany stanu fizycznego.
Zmiany stanu fizycznego to:
Połączenie: przejście ze stanu stałego do stanu ciekłego;
Zestalenie: przejście ze stanu ciekłego do stanu stałego;
Odparowanie: przejście ze stanu ciekłego do stanu gazowego;
Kondensacja: przejście ze stanu gazowego do ciekłego;
Sublimacja: przejście ze stanu stałego do stanu gazowego;
Resublimacja: przejście z gazu do stanu stałego.
a) Regiony
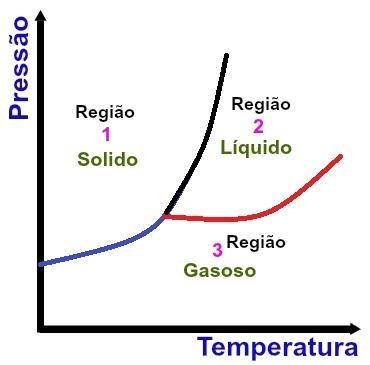
Podstawowe obszary diagramu fazowego
Region 1
Region 1 wskazuje warunki temperatury i ciśnienia, w których znajdujemy substancję w stanie stałym.
Region 2
Region 2 wskazuje warunki temperatury i ciśnienia, w których znajdujemy substancję w stanie ciekłym.
Region 3
Region 3 wskazuje warunki temperatury i ciśnienia, w których znajdujemy substancję w stanie gazowym.
b) Krzywe

Krzywe obecne na diagramie fazowym
Krzywa A (fioletowa krzywa)
Jest to krzywa dzieląca obszar stały i gazowy diagramu fazowego i jest powszechnie nazywana krzywą resublimacji. Każdy punkt znajdujący się na krzywej 1 wskazuje, że mamy pewną substancję współistniejącą w stanie stałym i gazowym.
Oprócz wskazania współistnienia, krzywa 2 wskazuje również warunki temperatury i ciśnienia dla przekształcenia substancji ze stanu ciekłego w stan gazowy.
Krzywa B (czarna krzywa)
Jest to krzywa, która dzieli obszar stały i ciekły diagramu fazowego i jest powszechnie nazywana krzywą krzepnięcia. Każdy punkt znajdujący się na krzywej 2 wskazuje na współistnienie pewnej substancji w stanie stałym i gazowym.
Oprócz wskazania współistnienia, krzywa 2 wskazuje również warunki temperatury i ciśnienia dla przekształcenia substancji znajdującej się w stanie ciekłym w stan stały.
Krzywa C (czerwona krzywa)
Jest to krzywa, która dzieli obszar stały i gazowy diagramu fazowego i jest powszechnie nazywana krzywą kondensacji. Każdy punkt znajdujący się na krzywej 3 wskazuje na współistnienie pewnej substancji w stanie stałym i gazowym.
Oprócz wskazania współistnienia, krzywa 3 wskazuje również warunki temperatury i ciśnienia dla przemiany substancji ze stanu stałego w stan gazowy i odwrotnie.
c) Punkt potrójny
Punkt, w którym spotykają się trzy krzywe na diagramie fazowym, nazywany jest punktem potrójnym. W tym momencie mamy wartość temperatury i wartość ciśnienia, przy której znajdujemy jednocześnie substancję w stanie stałym, ciekłym i gazowym.

d) Zmiany stanu fizycznego na wykresie fazowym
Na poniższym diagramie fazowym mamy 6 strzałek, które wskazują kierunek zmian stanów fizycznych substancji.

Strzałka 1: wskazuje połączenie
Strzałka 2: wskazuje krzepnięcie
Strzałka 3: wskazuje waporyzację
Strzałka 4: wskazuje kondensację
Strzałka 5: wskazuje na sublimację
Strzałka 6: wskazuje na resublimację
Przeze mnie Diogo Lopes Dias
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-diagrama-fases.htm
