W życiu codziennym iw laboratoriach zachodzą spontaniczne reakcje i przemiany, a inne nie są spontaniczne. Na przykład, całe spalanie jest reakcją spontaniczną, ponieważ raz rozpoczęte, będzie trwało aż do całkowitego zużycia paliwa lub do wyczerpania całego tlenu.
Z drugiej strony elektroliza jest procesem niespontanicznym, w którym energia elektryczna jest przekształcana w energię chemiczną. Przykładem jest elektroliza chlorku sodu (NaCl). Kiedy prąd elektryczny jest przepuszczany przez tę stopioną sól, zachodzą reakcje redoks i tworzenie metalicznego sodu (Na(y)) i chloru gazowego (Cl2(g)). Jeśli przestaniemy płynąć prądem elektrycznym, reakcja nie będzie kontynuowana sama, co pokazuje, że nie jest spontaniczna.
Spontaniczność reakcji można zmierzyć za pomocą Równanie Gibbsa-Helmholtza, podane poniżej:

Na czym:
∆G = zmiana energii swobodnej;
∆H = zmiana entalpii;
T = temperatura w kelwinach (zawsze dodatnia);
∆S = zmiana entropii.
To równanie bierze swoją nazwę, ponieważ zostało zaproponowane przez amerykańskiego fizyka J. Willarda Gibbsa (1839-1903) i niemieckiego fizyka Hermanna Helmholtza (1821-1894).
Aby lepiej zrozumieć, w jaki sposób to równanie pomaga nam określić spontaniczność reakcji, przyjrzyjmy się pokrótce każdemu z zawartych w nim pojęć:
- ∆H (zmienność entalpii): Entalpia (H) to zawartość energii substancji. Jak dotąd nie wiadomo, jak to ustalić. W praktyce osiąga się pomiar zmienności entalpii (∆H) procesu za pomocą kalorymetrów. Ta zmiana to kwota energia, która została uwolniona lub pochłonięta w procesie.
- ∆S (zmienność entropii):Entropia (S) to wielkość termodynamiczna, która mierzy stopień nieuporządkowania w systemie.
Na przykład w topiącym się lodzie cząsteczki przechodzą ze stanu stałego do stanu ciekłego, gdzie występuje większa dezorganizacja. Oznacza to, że w procesie tym entropia wzrosła (∆S > 0).
W produkcji amoniaku (NH3), 1 mol gazowego azotu reaguje z 3 molami gazowego wodoru (czyli 4 molami cząsteczek w reagentach), dając 2 mole amoniaku:
N2(g) +3 godz2(g) → 2 NH3(g)
Ponieważ w procesie tym zmniejsza się liczba cząsteczek w fazie gazowej, zmniejszyła się dezorganizacja, co oznacza, że zmniejszyła się również entropia (∆S< 0).
- ∆G (darmowa energia): Darmowa energia lub Energia swobodna Gibbsa (ponieważ został zaproponowany dopiero przez tego naukowca w 1878 r.) jest użyteczna energia systemu, która jest wykorzystywana do wykonywania pracy.
System ma energię globalną, ale tylko ułamek tej energii zostanie wykorzystany do wykonania pracy, nazywa się to energią swobodną Gibbsa, symbolizowaną przez sol.
Według Gibbsa proces jest uważany za spontaniczny, jeśli wykonuje pracę, to znaczy, gdy G maleje. W takim przypadku stan końcowy transformacji będzie bardziej stabilny niż stan początkowy, gdy ∆G < 0.
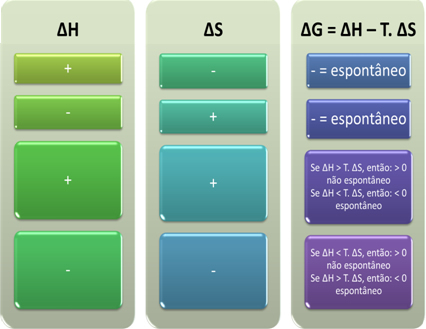
Na tej podstawie możemy stwierdzić, co następuje:

Możemy również zobaczyć, czy proces będzie spontaniczny, patrząc na znak algebraiczny ∆H i ∆S w równaniu Gibbsa-Helmholtza:
Jennifer Fogaça
Absolwent chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/energia-livre-gibbs.htm
