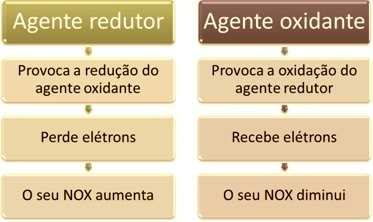
Jedna z głównych cech wyróżniających reakcję utleniania-redukcji (lub ( redoks) pozostałych to obecność środka utleniającego i środka redukującego, które można zdefiniować w następujący sposób:
Na przykład spójrz na reakcję chemiczną poniżej, w której aluminium (Al) koroduje w wodnym roztworze kwasu chlorowodorowego (HCl). Atomy glinu przenoszą elektrony na kationy H+(tutaj) i wyprodukuj kation Al3+(tutaj):
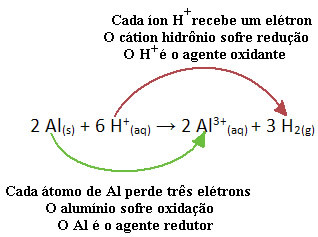
Zauważ, że skoro Al przeniósł elektrony, oznacza to, że on spowodował redukcję kationów H+(tutaj); dlatego nazywa się go Środek redukujący. Już kation H+(tutaj) usunął elektrony z aluminium, powodując utlenianie tego metalu; dlatego zachowuje się jak Środek utleniający.
W życiu codziennym istnieje wiele przykładów działania środków utleniających i redukujących. Przyjrzyj się niektórym z nich i pamiętaj, że we wszystkich przypadkach redukcja następuje jednocześnie z utlenianiem; dlatego, jeśli istnieje środek redukujący, istnieje również środek utleniający.
- Przykłady środków redukujących:
- W filmach fotograficznych: filmy fotograficzne zawierają światłoczułe sole srebra. W miejscach padania światła następuje redukcja jonów Ag+, co skutkuje kontrastem obserwowanym na negatywach.

- Witamina C: Witamina C (kwas L-askorbinowy) jest silnym środkiem redukującym w roztworze wodnym. Ma wyjątkowe właściwości utleniania i dlatego jest szeroko stosowany, zwłaszcza w żywności, takiej jak przeciwutleniacz, czyli jest dodawany do innych produktów spożywczych i chroni je przed ewentualnym utlenianiem dzięki własnemu poświęcać się. Przykładem są owoce, takie jak jabłka i gruszki, które ciemnieją w kontakcie z tlenem z powietrza, ponieważ utleniają się. Ale gdy do owocu dodasz niewielką ilość soku z pomarańczy lub cytryny (zawierających witaminę C) cięcia, zapobiega to występowaniu tej reakcji, ponieważ witamina C działa jako czynnik redukujący i utlenia się przed owocami.

- Wodór: gazowy wodór (H2) jest stosowany w napędach rakietowych i jest uważany za jedną z najważniejszych alternatyw energetycznych, ponieważ jego spalanie uwalnia dużą ilość energii i nie powoduje żadnych zanieczyszczeń. W tej reakcji wodór działa jako czynnik redukujący, utleniany przez tlen.
- Przykłady środków utleniających:
- W produkcji octu: wino wystawione na działanie powietrza zamienia się w ocet, którego głównym składnikiem jest kwas octowy. Dzieje się tak, ponieważ alkohol etylowy lub etanol obecny w winie utlenia się w kontakcie z tlenem atmosferycznym, w wyniku czego powstaje kwas octowy. Zatem tlen jest środkiem utleniającym. Nawet pochodzenie terminu „utlenianie” jest związane z reakcją z tlenem.

- W rdzy: jak stwierdzono w poprzednim przykładzie, tlen działa jako środek utleniający dla alkoholu; i robi to również w kontakcie z różnymi metalami, takimi jak żelazo, powodując proces rdzewienia. Oprócz tlenu w powietrzu innymi utleniaczami w tym przypadku są woda lub roztwór kwaśny.
- W wybielaczach: wybielający efekt wybielaczy wynika z obecności dwóch następujących środków redukujących: o anion podchlorynowy (najczęściej w postaci soli sodowej – NaOCl), występujący np. w wybielaczu; i nadtlenek wodoru (H2O2), sprzedawany jako nadtlenek wodoru. Te dwa związki mają bardzo silną tendencję do utleniania się i powodowania redukcji innych związków chemicznych. Dlatego odpowiadają za substancje utleniające, które nadają produktom ciemny kolor. Na przykład w celulozie lignina jest rozkładana i staje się lżejsza i bardziej plastyczna. W przypadku usuwania plam i wybielania tkanin te utleniacze powodują utlenianie cząsteczek organicznych, takich jak tłuszcze i barwniki.

- W alkomatach: prosty alkomat jednorazowy składa się z przezroczystej rurki zawierającej wodny roztwór soli dwuchromianowej potasu i krzemionki, zwilżony kwasem siarkowym; zmieszany z kolorem pomarańczowym. Sól ta w kontakcie z oparami alkoholu zawartymi w oddechu pijanego kierowcy reaguje zmieniając kolor na zielony. Oznacza to, że dochodzi do utleniania etanolu (alkoholu) do etanolu.

Jennifer Fogaça
Absolwent chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/conceito-exemplos-agente-redutor-agente-oxidante.htm
