TEN nihoniu, Liczba atomowa 113 i symbolem Nh, jest pierwiastkiem chemicznym należącym do grupy 13 układu okresowego. Dodatkowo jest superciężkim pierwiastkiem niespotykanym w naturze. Tak więc jego otrzymanie może być wykonane tylko sztucznie, poprzez reakcje syntezy jądrowej. Charakterystyka chemiczna nihonium nadal nie jest tak jasna, ale spekuluje się, że w niektórych przypadkach zachowuje się podobnie do swojego lżejszego odpowiednika, talu.
Nihonium początkowo otrzymywano przez topienie 70Zn z 209Bi, w Riken Institute, Japonia, 2003. Chociaż rosyjscy i amerykańscy naukowcy również poprosili o uznanie za odkrywców pierwiastka 113, IUPAC uznał naukowców japońskich. Nazwa nawiązuje do słowa Nihon, jak Japończycy nazywają swój ojczysty kraj.
Przeczytaj też: Gal — inny pierwiastek chemiczny należący do grupy 13 układu okresowego pierwiastków
podsumowanie o nihoniu
Jest to syntetyczny pierwiastek chemiczny znajdujący się w grupie 13 Układ okresowy pierwiastków.
Jego produkcja rozpoczęła się w 2003 roku w Riken Institute w Japonii.
Stanowi on grupę pierwiastków ostatnio uwzględnionych w układzie okresowym w 2015 roku.
Jego badania są wciąż bardzo nowe, ale niektórzy starają się powiązać je z innymi pierwiastkami z grupy 13, takimi jak tal.
Jego produkcja to Fuzja nuklearna, używając izotopów 70Zn i atomy 209Bi.
Właściwości nikonu
Symbol: nie
Liczba atomowa: 113
Masa atomowa: między 278 a 286 j.m. (nieoficjalne przez Iupac)
Elektroniczna Konfiguracja: [Rn] 7s2 5f14 6d10 7p1
Najbardziej stabilny izotop:286Nh (9,5 sekundy z pół życia, która może wzrosnąć o 6,3 sekundy lub zmniejszyć o 2,7 sekundy)
Seria chemiczna: grupa 13, super ciężkie elementy
charakterystyka nihonium
Nihonium, symbol Nh i liczba atomowa 113, był jednym z ostatnich elementów zawartych w układzie okresowym. Jego oficjalizacja odbyła się 30 grudnia 2015 r. przez Międzynarodową Unię Chemii Czystej i Stosowanej (IUPAC), podczas gdy jej nazwa została oficjalna dopiero w połowie 2016 r.
Pierwiastki w tym obszarze Układu Okresowego są wysoce niestabilne, co oznacza, że nie można ich znaleźć w naturze. Tak więc, w obliczu rzekomego istnienia, niemal natychmiast ulegałyby rozpadowi radioaktywnemu — emisji cząstek jądrowych, takich jak α i β — w celu osiągnięcia większej stabilności.
Jednak kiedy emitują cząstki jądrowe, w końcu przechodzą transmutację jądrową, czyli stają się nowym pierwiastkiem chemicznym. Tak więc pierwiastki superciężkie, takie jak Nh, muszą być produkowane w laboratorium, co sprawia, że syntetyczny pierwiastek chemiczny.
Na Nh, podobnie jak na inne superciężkie pierwiastki, ma wpływ efekty relatywistyczne — w prosty sposób odległości od tego, co obserwujemy, do tego, czego oczekiwano, ze względu na teorię względności. Tak więc badania matematyczne z dziedziny teoretycznej, które symulują konsekwencje efektu relatywistycznego, wskazały, że nihonium może słabo oddziaływać z kwarcem, ale mieć dobra adsorpcja do złoto, podobnie jak jego lżejszy odpowiednik, tal (Tl).
Wstępne badania teoretyczne również wskazały na zmienność od NH. Jeśli chodzi o adsorpcję na kwarcu, tal łatwo tworzy na przykład T10OH, a podejrzewa się, że nihonium robi to samo.
Mimo to, jak? badania są wciąż bardzo wstępne i aktualne, wiele z tego, co zostało wyprodukowane, jest przedmiotem dyskusji i trudno jest dokładnie określić właściwości fizykochemiczne nihonium.
Zdobycie Nihonium
Pierwiastek 113 do dziś pozyskiwany był na dwa sposoby: poprzez reakcje zimnej fuzji, z fuzją cynku (Zn, Z = 30) z bizmutem (Bi, Z = 83), a także poprzez alfa rozpad pierwiastka 115.
W pierwszym przykładzie cynk jest przyspieszany do 10% prędkość światła, aby przezwyciężyć siły odpychające dwóch jąder. Następnie powstaje izotop 279Nh, co kończy się emisją neutronu i wytwarzaniem 278Nh.

Z okresem półtrwania około 34 milisekund, izotop 278Nh ulega sześciu rozpadom alfa (emisje cząstek alfa) do pierwiastka mendelevium (Md).
W drugim przypadku pierwiastek 113 powstaje w wyniku rozpadu alfa pierwiastka 115 (obecnie znanego jako muscovium) po jego zsyntetyzowaniu. Jednym ze sposobów jest reakcja gorącej fuzji jonów 48Ca z izotopami 243ach, tworząc 288Mc, a następnie, przez rozpad alfa, 284Nh, który nadal ulega rozpadowi alfa.
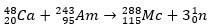
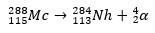
Zobacz też: Has — najcięższy syntetyczny pierwiastek chemiczny, którego właściwości poddawane są analizie
historia nihonium
Poszukiwania pierwiastka 113 rozpoczęły się w 2003 roku. Japońscy naukowcy z Riken Institute przyspieszyli izotopy 70Zn przy 10% prędkości światła w celu zderzenia z 209Bi, poprzez reakcję fuzji. W ten sposób udało im się wyprodukować to, co teraz znamy jako 278Nh.
Jednak dopiero w 2012 r. Japońscy naukowcy byli w stanie wykryć pełną serię rozpadów alfa elementu 113, kontaktując się z IUPAC, aby zażądać odkrycia.
Równolegle z japońskimi wysiłkami rosyjscy naukowcy kierowani przez Jurija Oganessiana, we współpracy z Amerykańscy naukowcy również doszli do identyfikacji pierwiastka 113 poprzez rozpady alfa pierwiastka 115. Takie eksperymenty stawiają również rosyjskich i amerykańskich naukowców w rywalizacji o rozpoznanie pierwiastka 113.

Jednak IUPAC uznał, że dowody z instytutu Riken są bardziej solidne, dzięki czemu Japończycy mają prawo do nazwania elementu 113. Wybrano nazwę nihônio, symbol Nh, w odniesieniu do kraju Japonia. Słowo Japonia jest pisane przez Japończyków przy użyciu dwóch chińskich znaków, które oznaczają „kraj wschodzącego słońca” i są czytane jako Nihon lub Nippon.
Nazwę nihonium wybrano również dlatego, że w 1908 roku japoński chemik Masataka Ogawa ją opublikował odkrył pierwiastek 43, nazywając go japońskim symbolem Np (który dziś należy do neptunium, Z = 93). Jednak później okazało się, że pierwiastek 43 był niestabilny, nie występujący w przyrodzie i zsyntetyzowany dopiero w 1937 roku, otrzymując nazwę technet (Tc).
Tym samym Japończycy zniknęli z układu okresowego. Jednak po latach udowodniono, że w rzeczywistości Ogawa odkrył pierwiastek 75 (obecnie znany jako ren). Jednak do tego czasu pierwiastek ren został już oficjalnie odkryty w 1925 roku i ochrzczony.
Rozwiązane ćwiczenia na nihonium
Pytanie 1
Nihonium, symbol Nh i liczba atomowa 113, to pierwiastek chemiczny, którego nie można znaleźć w przyrodzie ze względu na krótki okres półtrwania. Najtrwalszy z nich, 286Nh, ma około 9,5 sekundy. Wiedząc, że okres półtrwania to czas, w którym liczebność gatunku spadnie o połowę, ile sekund potrzeba, aby ilość powyższego izotopu wynosiła 1/16 ilości Inicjał?
A) 9,5
B) 19
C) 28,5
D) 38
E) 47,5
Rezolucja:
Alternatywa D
Co 9,5 sekundy ilość izotopu spada o połowę. Tak więc po 9,5 sekundy jego kwota wynosi połowę początkowej kwoty. Kolejne 9,5 sekundy, w sumie 19 sekund, ilość spada ponownie o połowę, osiągając 1/4 początkowej.
Po 28,5 sekundy, po kolejnym okresie półtrwania, ilość ponownie spada o połowę, osiągając 1/8 początkowej ilości. Ostatecznie, po 38 sekundach, kwota ponownie spada o połowę, osiągając 1/16 początkowej kwoty, o którą prosiliśmy w oświadczeniu. Zatem wymagany czas to 38 sekund.
pytanie 2
W 2003 roku w Riken Institute w Japonii rozpoczęły się poszukiwania pierwiastka 113. W tym czasie naukowcy byli w stanie wyprodukować 278Nh poprzez fuzję atomów cynku i bizmutu.
Ile neutronów znajduje się w cytowanym izotopie?
A) 113
B) 278
C) 391
D) 170
E) 165
Rezolucja:
Alternatywne E
Liczba neutrony można obliczyć jako:
A = Z + n
gdzie A jest liczbą makaron atomowy, Z to liczba atomowa, a n to liczba neutronów. Zastępując wartości, mamy:
278 = 113 + n
n = 278 - 113
n = 165
Stefano Araújo Novais
Nauczyciel chemii

