TEN okresowa klasyfikacja pierwiastków został zaproponowany w 1913 r. przez Henry'ego Monseleya (1887-1915), który zidentyfikował okresową zmienność wielu właściwości w regularnych odstępach czasu w zależności od liczby protonów w jądrze atomu pierwiastka chemiczny.
Z powodu Prawo okresowości, kryterium używanym do uporządkowania elementów aktualnego układu okresowego jest rosnąco porządek liczby atomowej (Z).
118 pierwiastków chemicznych jest ułożonych w grupy i okresy układu okresowego. Zgodnie z właściwościami fizycznymi i chemicznymi można rozróżnić metale, niemetale (niemetale) i półmetale (metaloidy).

Linie pionowe to 18 grup tabeli i łączyć pierwiastki o podobnych właściwościach chemicznych. Linie poziome odpowiadają 7 okresów i przedstawia elementy z taką samą liczbą warstw elektronicznych.
Wodór to pierwiastek, który ze względu na swój rozkład elektroniczny plasuje się powyżej grupy 1, ale nie ma z nimi wspólnych cech.
Sprawdź Układ okresowy pierwiastków kompletne i zaktualizowane.
metale
Większość pierwiastków chemicznych w układzie okresowym jest sklasyfikowana jako metale. Główne cechy metali to:
- Mają charakterystyczny połysk;
- Są gęste, plastyczne i ciągliwe;
- Są dobrymi przewodnikami elektryczności i ciepła;
- Są one obecne w warunkach otoczenia w stanie stałym, z wyjątkiem rtęci.
Metaliczne elementy układu okresowego to:
metale alkaliczne (grupa 1): lit, sód, potas, rubid, cez i frans.
metale ziem alkalicznych (grupa 2): beryl, magnez, wapń, stront, bar i rad.
Sprawy reprezentatywne, oprócz pierwiastków z grup 1 i 2, to: glin, gal, ind, tal, anion, cyna, ołów, flerow, bizmut, muskow i wątrobowiec.
Zewnętrzne metale przejściowe to pierwiastki, które zajmują centralną część układu okresowego:
- Grupa 3: skand i itr.
- Grupa 4: tytan, cyrkon, hafn i rutherford.
- Grupa 5: wanad, niob, tantal i dubniu.
- Grupa 6: chrom, molibden, wolfram i seaborgium.
- Grupa 7: mangan, technet, ren i bor.
- Grupa 8: żelazo, ruten, osm i has.
- Grupa 9: kobalt, rod, iryd i meitner.
- Grupa 10: nikiel, pallad, platyna, darmstadium.
- Grupa 11: miedź, srebro, złoto i rentgen.
- Grupa 12: cynk, kadm, rtęć i kopernik.
Wewnętrzne metale przejściowe są pierwiastkami należącymi do grupy 3 i odpowiadają pierwiastkom serii lantanowców i aktynowców.
Seria lantanowców składa się z lantanu, ceru, prazeodymu, neodymu, prometu, samaru, europu, gadolinu, terbu, dysprozu, holmu, erbu, tulu, iterbu i lutetu.
Seria aktynowców zawiera aktyn, tor, protaktyn, uran, neptun, pluton, ameryk, kiur, berkel, kaliforn, einstein, ferm, mendelew, nobel i laurence.
Przeczytaj więcej o metale alkaliczne.
niemetale
Niemetale znajdują się w prawej części układu okresowego i mają właściwości przeciwne do metali, na przykład:
- Nie mają błyszczącego wyglądu;
- Nie są dobrymi przewodnikami elektryczności i ciepła, dlatego są używane jako izolatory;
- Mają niską temperaturę wrzenia i topnienia, dlatego wiele z nich występuje w naturze w stanie ciekłym.
ty elementy niemetalowe Układu Okresowego pierwiastków to: wodór, azot, tlen, węgiel, fosfor, selen, siarka, halogeny i gazy szlachetne.
ty halogeny to pierwiastki należące do grupy 17: fluor, chlor, brom, jod, astat, tennessyna oraz rodzina gazów szlachetnych.
ty Gazy szlachetne to pierwiastki należące do grupy 18: hel, neon, argon, krypton, ksenon, radon, oganesson.
Dowiedz się więcej o Gazy szlachetne i halogeny.
półmetale
Półmetalami lub metaloidami są: bor, krzem, german, arsen, antymon, tellur i polon. Pierwiastki te mają cechy pośrednie między metalami i niemetalami.
Przeczytaj także o rodziny układu okresowego pierwiastków.
Elementy reprezentatywne i przejściowe
Innym sposobem klasyfikacji elementów jest podzielenie ich na elementy reprezentatywne i przejściowe zgodnie z elektroniczna dystrybucja atomu.
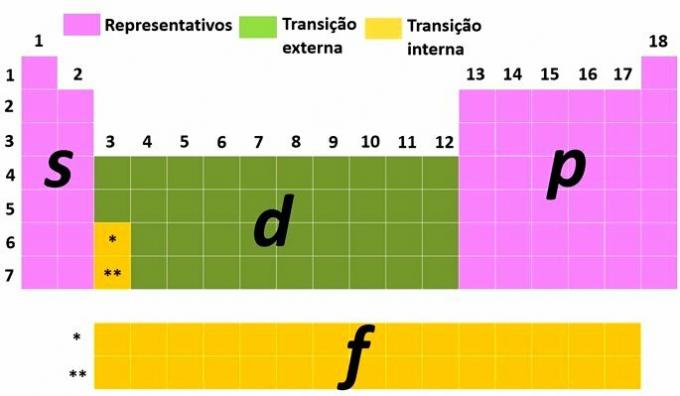
ty Reprezentatywne elementy to te, które mają konfigurację elektroniczną kończącą się najbardziej energetycznym podpoziomem w s (grupy 1 i 2) lub dla (grupy 13, 14, 15, 16, 17 i 18).

ty elementy przejściowe są podzielone na przejście zewnętrzne, z elementami, które mają najbardziej energetyczny elektron na podpoziomie D i te z wewnętrzne przejście, gdzie najbardziej energetyczny elektron znajduje się na podpoziomie F.

Zdobądź więcej wiedzy dzięki zawartości:
- okresowe właściwości
- Ćwiczenia układu okresowego
- Ćwiczenia z organizacji układu okresowego pierwiastków