Elektroliza jest to proces niespontaniczny, to znaczy taki, który nie zachodzi naturalnie, w którym substancje powstają w wyniku wyładowania elektrycznego w związkach stopionych lub rozpuszczonych w wodzie. W tym procesie prąd elektryczny dociera do szklanego pojemnika (zbiornika elektrolitu), który ma dwie obojętne elektrody (które nie cierpią ani nie utlenianie ani zmniejszenie) utworzony przez grafit lub platynę. Te elektrody są podłączone do źródła elektrycznego (zwykle bębny) i zanurzone w soli lub bazie stopionej lub rozpuszczonej w wodzie. Tak jak bateria, elektroliza ma katodę (gdzie następuje redukcja) i anodę (gdzie zachodzi utlenianie).
streszczenie
Elektroliza jest procesem niespontanicznym;
Mogą powstawać substancje proste lub złożone;
Może wystąpić w przypadku stopionej substancji rozpuszczonej (elektroliza magmowa);
Może wystąpić z substancją rozpuszczoną w wodzie (elektroliza wodna);
Kation zawsze ulega redukcji na katodzie;
Anion zawsze ulega utlenieniu na anodzie.
Zobacz też:Pozyskiwanie aluminium z elektrolizy

Rodzaje elektrolizy
Jest to elektroliza, która zachodzi, gdy na stopionym związku jonowym następuje wyładowanie elektryczne. Związek jonowy to związek utworzony przez wiązanie jonowe, takie jak a Sól lub baza nieorganiczny. Kiedy mówimy o stopionym związku, z kolei mamy na myśli związek, który przechodzi ze stanu stałego w ciekły.
- Przykład elektrolizy magmowej
Kiedy wykonujemy fuzję chlorku potasu (KCl), sól ta ulega dysocjacji, uwalniając kation potasu (K+) i anion jodkowy (l-).

Równanie dysocjacji chlorku potasu potassium
Kiedy prąd elektryczny dociera do ogniwa elektrolitycznego z tymi jonami, kation potasu jest redukowany, tworząc metaliczny potas (K), a anion jodkowy jest utleniany, tworząc stały jod (I2).
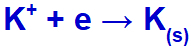
Równanie tworzenia potasu w stanie stałym
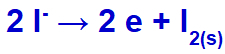
Równanie tworzenia jodu stałego
Jest to elektroliza, która zachodzi, gdy wyładowanie elektryczne jest przeprowadzane w roztworze wodnym (zawiera wodę) utworzonym przez sól lub zasadę nieorganiczną.
- Przykład elektrolizy wodnej
Gdy rozpuszczamy chlorek sodu w wodzie, dysocjuje, a woda ulega jonizacji:

Jonizacja wody i równania dysocjacji chlorku sodu
Jako kation sodu (Na+) należy do rodziny IA, kation hydroniowy (H+) przechodzi przez wyładowanie i ulega redukcji, tworząc gazowy wodór (H2).
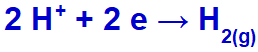
Równanie tworzenia gazu wodorowego
Jako chlorek (Cl-) nie jest natleniony (nie zawiera tlenu) i nie jest fluorkiem (F-), jest odprowadzany, utleniając się i tworząc gazowy chlor (Cl2).

Równanie tworzenia chloru gazowego
Selektywne wyładowanie jonów
Podczas procesu elektrolizy w środowisku wodnym (roztwór tworzony przez wodę i substancję rozpuszczoną) zawsze będziemy mieć dwa kationy: hydroniowy, z wody i każdy inny, z dysocjacja soli (przykład substancji rozpuszczonej). Będziemy też mieli dwa aniony: hydroksyl, który pochodzi z wody i drugi, który pochodzi z soli.

Jony z jonizacji wody i dysocjacji soli
- Selektywne odprowadzanie kationów i anionów
Jeśli kation z substancji rozpuszczonej należy do rodziny IA, IIA lub IIIA, hydronium (H+) zostanie zredukowane;
Jeśli kation pochodzący z substancji rozpuszczonej nie należy do wyżej wymienionych rodzin, ulegnie redukcji.
Jeśli anion z substancji rozpuszczonej ma w swoim składzie tlen lub jest fluorkiem (F-), wodorotlenek (OH-) ulegnie utlenianiu;
Jeśli anion z substancji rozpuszczonej nie będzie miał powyższych właściwości, ulegnie utlenieniu.
Wiadomo, że woda ma zdolność samojonizacji, wytwarzając jony hydroniowe (H+) i wodorotlenek (OH-), ale ta jonizacja jest dość ograniczona. Świadczy o tym nieefektywność czystej wody w przewodzeniu prądu elektrycznego.
Jak na przykład elektroliza polega na wyładowaniu elektrycznym, aby przeprowadzić elektrolizę wody, konieczne jest rozpuszczenie substancji rozpuszczonej, co sprzyja selektywnemu odprowadzaniu hydronu i wodorotlenku (jak widać w temacie dotyczącym odprowadzania) selektywny).
Jeśli dodamy siarczan sodu (Na2TYLKO4), na przykład kationy sodu będziemy mieć w środku (Na+) i hydronium (H+), a także aniony wodorotlenkowe (OH-) i siarczan (SO4-2). Tak więc, gdy prąd elektryczny dotrze do zbiornika elektrolitycznego:
hydronium zostanie uwolniony, redukując, ponieważ sód należy do rodziny IA;
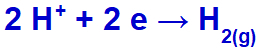
Równanie tworzenia gazu wodorowego
wodorotlenek ulegnie rozładowaniu, utlenianiu, ponieważ siarczan ma w swoim składzie tlen.
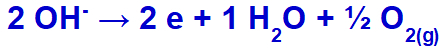
Równanie tworzenia gazu tlenowego
Ponieważ dwa jony (kation i anion) pochodzące z wody zostały wyrzucone, mówimy, że nastąpiła elektroliza wody.
Zobacz też: Ilościowe aspekty elektrolizy
Produkcja prostych substancji, takich jak gazowy wodór (H2), gazowy tlen (O2) itp.;
Produkcja substancji złożonych takich jak wodorotlenek sodu (NaOH), kwas siarkowy (H2TYLKO4) itp.;
Powlekanie części określonym metalem, takim jak miedź (miedź) i złoto (złocenie);
Użyj, aby usunąć określony metal z rudy.
Rozwiązane Ćwiczenia dotyczące elektrolizy
Przykład 1 - (Vunesp) Wodny roztwór CuCℓ2 jest poddawany elektrolizie przy użyciu elektrod platynowych. Prawidłowe stwierdzenie to:
a) Redukcja jonów Cu następuje na katodzie2+.
b) Utlenianie jonów Cu zachodzi na anodzie2+.
c) Na katodzie powstaje gazowy chlor.
d) Część anody platynowej rozpuszcza się, tworząc Pt2+.
e) Produkty tej elektrolizy byłyby inne, gdyby elektroliza CuCl2 były ogniste (fusion).
a) Prawidłowo. Kiedy CuCl2 rozpuszcza się w wodzie, mamy kationy hydroniowe (H+) i miedzi II (Cu+2). Ponieważ kation miedzi II nie należy do rodzin IA, IIA i IIIA, jest redukowany.
b) Fałsz, ponieważ anion chlorkowy (Cl) utlenia się na anodzie-), który nie zawiera w swoim składzie tlenu i nie jest fluorkiem (F-).
c) Fałsz, ponieważ redukcja kationu miedzi II zachodzi na katodzie, a zatem powstaje metaliczna miedź.
d) Fałsz, ponieważ elektrody platynowe lub grafitowe w elektrolizie tylko przewodzą prąd, nie uczestniczą w procesie.
e) Fałsz, ponieważ magmowa elektroliza chlorku miedzi II (CuCl2) przedstawiałby dokładnie te same produkty co wodny, ponieważ obecne jony byłyby miedzią II (Cu+2) i chlorek (Cl-1).
Przykład 2 (UFRN) Rozważ następujące systemy:
JA. stopiony chlorek sodu;
II. Wodny roztwór chlorku sodu;
III. Topiony wodorotlenek sodu;
IV. Wodny roztwór wodorotlenku sodu.
Te, które mogą dostarczać sód po poddaniu elektrolizie, to:
a) tylko I i II.
b) tylko I i III.
c) tylko II i IV.
d) tylko III i IV.
e) I, II, III i IV.
Systemy, które dostarczają metaliczny sód jako produkt na katodzie to I i III.
I- Jedynym kationem obecnym w pożywce jest kation sodu, dlatego tylko on może redukować, tworząc metaliczny sód.
II- Ten system nie zapewnia metaliczny sód, ponieważ chlorek sodu był rozpuszczony w wodzie, więc w środku mamy obecność kationów sodu (Na+) i hydronium (H+) - to ten, który cierpi na redukcję, ponieważ sód należy do rodziny IA.
III- Jedynym kationem obecnym w pożywce jest kation sodu (ponieważ materiał został poddany fuzji), dlatego tylko on ulega redukcji, tworząc metaliczny sód;
IV- Ten system nie zapewnia metaliczny sód, ponieważ wodorotlenek sodu był rozpuszczony w wodzie, więc w środku mamy obecność kationów sodu (Na+) i hydronium (H+) - to ten, który cierpi na redukcję, ponieważ sód należy do rodziny IA.
Przeze mnie Diogo Lopes Dias

