Im wyższa temperatura, tym większa szybkość reakcji.
Można to łatwo zaobserwować w wielu sytuacjach w naszym codziennym życiu, jak na poniższych przykładach:
- Kiedy chcemy spowolnić reakcję rozkładu żywności, obniżamy temperaturę, umieszczając ją w lodówce;

- Jeśli chcemy przyspieszyć reakcję gotowania potrawy, wystarczy włożyć ją do garnka. ciśnienie, które wraz ze wzrostem ciśnienia zwiększa również temperaturę wrzenia ciekłej wody, w której jedzenie jest;

- Pożary, ogólnie rzecz biorąc, są zwykle niszczycielskie, ponieważ wzrasta temperatura otoczenia, co powoduje wzrost szybkości reakcji spalania;
- Aby spowolnić metaboliczne procesy chemiczne, zmniejszając ryzyko uszkodzenia mózgu z powodu niedobór tlenu, niektóre operacje wykonywane są poprzez obniżenie temperatury ciała pacjenta, pozostając na poziomie około 15°C;
- Jeśli włożymy jedną tabletkę musującą do szklanki gorącej wody, a drugą do szklanki zimnej wody, ta pierwsza rozpuści się znacznie szybciej.
Ale co tłumaczy wprost proporcjonalny wpływ temperatury na szybkość reakcji?
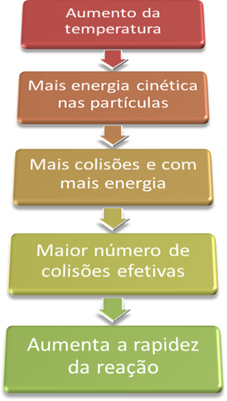
Dzieje się tak, ponieważ, jak wyjaśniono w tekście „Warunki występowania reakcji chemicznych”, aby reakcja mogła przebiegać, konieczne jest spełnienie pewnych warunków, takich jak to, że cząstki muszą zderzać się skutecznie i z minimalną wymaganą energią, która nazywa się energią aktywacji.
Zatem wraz ze wzrostem temperatury układu zwiększamy również pobudzenie reagujących cząstek i dostarczamy im więcej energii kinetycznej. Dzięki temu nastąpi więcej zderzeń i więcej energii, zwiększając ilość cząstek, które będą reagowały, a w konsekwencji zwiększając szybkość reakcji.
Jennifer Fogaça
Absolwent chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/temperatura-velocidade-das-reacoes.htm



