Ty podstawowe tlenki są to te, które reagując z wodą dają początek zasadom. Kiedy reagują z kwasem, tworzą sól i wodę.
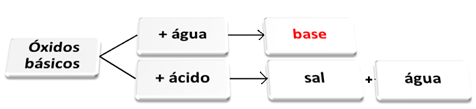
Tlenki zasadowe reagujące z wodą i kwasem.
Na przykład mamy tlenek sodu (Na2O), który jest tlenkiem zasadowym. Zobacz poniżej, że w reakcji z wodą tworzy zasadę wodorotlenku sodu:
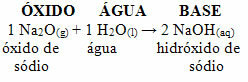
Jeśli ten sam tlenek reaguje z kwasem, takim jak kwas siarkowy (H2TYLKO4), zostanie wytworzona sól (siarczan sodu) i woda.
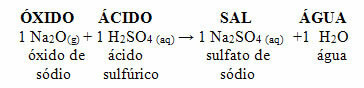
Jeśli zasadowy tlenek reaguje z tlenkiem kwasowym, powstaje również sól, ale bez wody.
Jak pokazano w przedstawionym przykładzie, pozostałe tlenki zasadowe są również związkami jonowymi, powstającymi w ich głównie przez metale, pierwiastki, które są silnie elektrododatnie, zwykle prezentujące „ładunek” równy +1 lub +2.
Przykłady:
Na2O = Na1+
K2O = K1+
CaO = Ca2+
MgO = Mg2+
Związki te mają wysokie temperatury topnienia i wrzenia i wszystkie zawierają anion tlenu (O2-).
Zastosowania niektórych podstawowych tlenków:
• Pies: Tlenek wapnia
Ten związek jest powszechnie znany jako niegaszone wapno
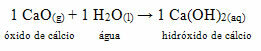

Malowanie bielone.
• K2O: tlenek potasu
Tlenek potasu powszechnie występuje w drewnie i popiele papierosowym. W reakcji z wodą tworzy zasadowy wodorotlenek potasu (KOH), używany do produkcji mydeł. Nawet w przeszłości, w miejscach, gdzie nie było KOH, stosowano popioły roślinne, które zawierały K2O, aby wejść w reakcję z tłuszczami i wytworzyć tzw „szare mydło”.
Jennifer Fogaça
Absolwent chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/oxidos-basicos.htm

