Izomeria chemiczna to zjawisko obserwowane, gdy dwie lub więcej substancji organicznych ma ten sam wzór cząsteczkowy, ale inną strukturę i właściwości cząsteczkowe.
Substancje chemiczne o tych właściwościach nazywane są izomerami.
Termin ten pochodzi od greckich słów iso = równy i tylko = części, czyli równe części.
Istnieją różne rodzaje izomerii:
- płaski izomer: Związki są identyfikowane przez płaskie wzory strukturalne. Dzieli się na izomerię łańcuchową, izomerię funkcji, izomerię pozycyjną, izomerię kompensacyjną i izomerię tautomeryzmu.
- izomer kosmiczny: Struktura molekularna związków ma różne struktury przestrzenne. Dzieli się na izomerię geometryczną i optyczną.
płaski izomer
W płaska izomeria lub izomeria konstytucyjna, struktura molekularna substancji organicznych jest płaska.
Związki wykazujące tę cechę nazywane są izomerami płaskimi.
izomer łańcuchowy
Izomeria łańcuchowa ma miejsce, gdy atomy węgla mają różne łańcuchy i tę samą funkcję chemiczną.
Przykłady:
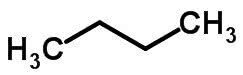
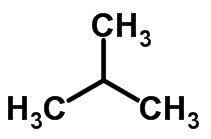
Izomeria funkcji
Izomeria funkcji występuje, gdy dwa lub więcej związków ma różne funkcje chemiczne i ten sam wzór cząsteczkowy.
Przykłady: Ten przypadek jest powszechny w przypadku aldehydów i ketonów.
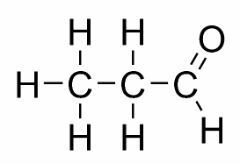
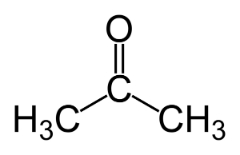
Izomer pozycji
Izomeria pozycyjna występuje, gdy związki są zróżnicowane przez różne pozycje nienasycenia, rozgałęzienia lub grup funkcyjnych w łańcuchu węglowym. W tym przypadku izomery pełnią tę samą funkcję chemiczną.
Przykłady:

równoważący izomer
Izomeria kompensacyjna lub metameryzm występuje w związkach o tej samej funkcji chemicznej, które różnią się położeniem heteroatomów.
Przykłady:

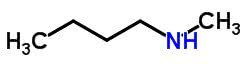
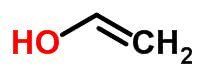
Tautomery
Tautomerię lub izomerię dynamiczną można uznać za szczególny przypadek izomerii funkcji. W takim przypadku jeden izomer może zmienić się w inny, zmieniając położenie elementu w łańcuchu.
Przykłady:

izomer kosmiczny
TEN izomeria kosmiczna, zwany również stereoizomerią, ma miejsce, gdy dwa związki mają ten sam wzór cząsteczkowy i różne wzory strukturalne.
W tego typu izomerii atomy są rozmieszczone w ten sam sposób, ale zajmują różne pozycje w przestrzeni.
izomer geometryczny
TEN izomeria geometryczna lub cis-trans występuje w nienasyconych łańcuchach otwartych, a także w związkach cyklicznych. Aby to zrobić, ligandy węglowe muszą być różne.

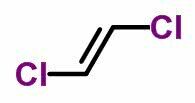
- Gdy te same ligandy znajdują się po tej samej stronie, nomenklatura izomerów otrzymuje przedrostek cis.
- Gdy te same ligandy znajdują się po przeciwnych stronach, nomenklatura otrzymuje przedrostek trans.
IUPAC (Międzynarodowa Unia Chemii Czystej i Stosowanej) zaleca, aby zamiast cis i trans jako przedrostka używać liter Z i E.
Dzieje się tak, ponieważ Z jest pierwszą literą niemieckiego słowa zusammen, co oznacza „razem”. I to jest pierwsza litera niemieckiego słowa entegegen, co oznacza „naprzeciw”.
izomer optyczny
TEN izomeria optyczna wykazują związki, które są optycznie czynne. Dzieje się tak, gdy substancja jest spowodowana odchyleniem kątowym w płaszczyźnie światła spolaryzowanego.
- Kiedy substancja zagina światło optyczne w prawo, nazywa się to praworęczny.
- Gdy substancja zagina światło optyczne w lewo, nazywa się ją lewoskrętny.
Substancja może również występować w dwóch optycznie czynnych formach: dextogyra i lewogyra. W tym przypadku nazywa się to enancjomer.
Aby związek węgla był optycznie aktywny, musi być chiralny. Oznacza to, że ich ligandy nie mogą się nakładać, ponieważ są asymetryczne.
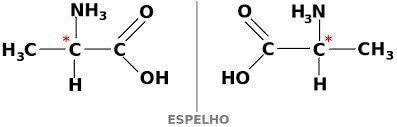
Z kolei, jeśli związek ma postać prawoskrętną i lewoskrętną w równych częściach, nazywa się je mieszaniny racemiczne. Aktywność optyczna mieszanin racemicznych jest nieaktywna.
Przeczytaj też:
- Węgiel
- Chemia organiczna
- Formuła molekularna
- formuła strukturalna
Ćwiczenia
1. (Mackenzie 2012) Numer kolumny B, która zawiera związki organiczne, kojarząc je z kolumną A, zgodnie z typem izomerii, jaki przedstawia każda cząsteczka organiczna.
Kolumna A
1. równoważący izomer
2. izomer geometryczny
3. izomer łańcuchowy
4. izomer optyczny
Kolumna B
( ) cyklopropan
( ) etoksy-etan
( ) bromo-chloro-fluoro-metan
( ) 1,2-dichloroeten
Prawidłowa sekwencja liczb w kolumnie B, od góry do dołu, to
a) 2 - 1 - 4 - 3.
b) 3 - 1 - 4 - 2.
c) 1 - 2 - 3 - 4.
d) 3 - 4 - 1 - 2.
e) 4 - 1 - 3 - 2.
Alternatywa b) 3 - 1 - 4 - 2.
2. (Uerj) Izomeria to zjawisko charakteryzujące się tym, że ten sam wzór cząsteczkowy reprezentuje różne struktury.
Biorąc pod uwagę płaską izomerię strukturalną dla wzoru cząsteczkowego C4H8, możemy zidentyfikować izomery następujących typów:
a) łańcuch i pozycja
b) łańcuch i funkcja
c) funkcja i kompensacja
d) pozycja i odszkodowanie
Alternatywa a) ciąg i pozycja
3. (OSEC) Propanon i izopropenol stanowią przykład izomerii:
a) metamerii
b) funkcji
c) tautomery
d) cis-tran
e) łańcuch
Alternatywa c) tautomery
Zobacz też: Ćwiczenia z płaskiej izomerii

