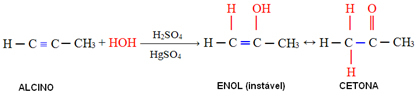
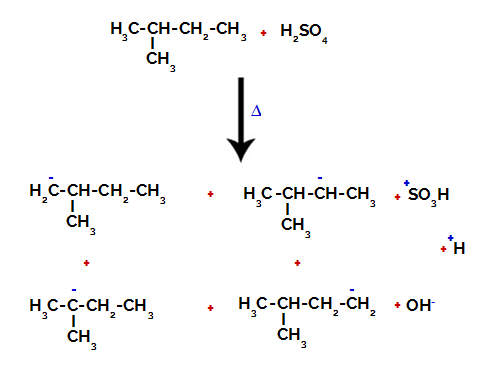
Wzór strukturalny to schemat, który wskazuje strukturę, czyli rozmieszczenie atomów tworzących pierwiastki chemiczne, a także połączenie między nimi. Może być reprezentowany na różne sposoby: płaski, skondensowany lub elektroniczny.
Wśród czynników warunkujących zastosowane struktury jednym z nich jest liczba elektronów w powłoce walencyjnej.
Płaska formuła
Formuła płaska wykorzystuje myślniki do przedstawienia wiązań kowalencyjnych, które mogą być pojedyncze, podwójne lub potrójne i reprezentowane w następujący sposób:
– proste połączenie (gdy 2 elektrony są wspólne)
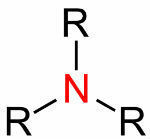
= wiązanie podwójne (gdy 4 elektrony są wspólne)
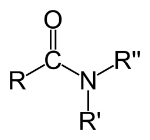
≡ potrójne łącze (gdy dzieli się 6 elektronów)
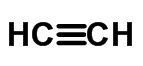
Skrócona lub uproszczona formuła
W skróconym wzorze strukturalnym wiązania nie są pokazane.
W jego reprezentacji liczba atomów każdego pierwiastka jest wskazana w sposób skondensowany, czyli uproszczony:
H3C CH2 CH2 CH3
Liniowa formuła skondensowana
Liniowo skrócony wzór wykorzystuje linie zygzakowate, w których wierzchołkach są reprezentowane węgle:
Formuła elektroniczna lub Lewisa
Formuła elektroniczna, zwana także formułą Lewisa, jest reprezentowana przez kropki.
Poprzez te punkty pokazane są ilości elektronów obecnych w warstwach walencyjnych:
H: H
A wzór molekularny?
TEN formuła molekularna, bez odwoływania się do jego struktury, wskazuje liczbę elementów składających się na cząsteczka. Oprócz wskazania liczby atomów obecnych w każdym elemencie i ich proporcji.
Można go uzyskać za pomocą wzoru minimalnego lub empirycznego oraz wzoru procentowego lub setnego.
Przeczytaj też Izomeria i Warstwa Walencji.
Rozwiązane ćwiczenia
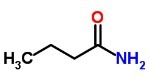
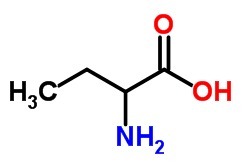
1. (Vunesp-2000) Napisz wzór strukturalny i podaj oficjalną nazwę:
a) nasycony keton o rozgałęzionym łańcuchu węglowym zawierający łącznie 7 atomów węgla.
b) aminokwas o 4 atomach węgla.
)

B)
2. (FGV-2005) Aspartam to sztuczny słodzik, który został przypadkowo odkryty w 1965 roku przez nieostrożnego chemika, który oblizał swoje brudne palce i poczuł, że są słodkie.
Te niehigieniczne nawyki nie są zalecane, ponieważ wiele substancji w niewielkich ilościach jest wysoce toksycznych.
Wzór strukturalny aspartamu przedstawiono poniżej:

Ze wzoru strukturalnego aspartamu wynika, że istnieje:
a) 13 atomów węgla na cząsteczkę.
b) 1 eterowa grupa funkcyjna.
c) 1 dipeptyd
d) 2 trzeciorzędowe atomy węgla
e) tylko 1 asymetryczny atom węgla.
Alternatywa c: 1 dipeptyd
Aby kontynuować sprawdzanie swojej wiedzy, zapoznaj się również z poniższymi listami ćwiczeń:
- Ćwiczenia na węglowodorach
- Ćwiczenia z chemii organicznej
- Ćwiczenia z płaskiej izomerii