Elektroliza to proces fizykochemiczny, który wykorzystuje energię elektryczną z dowolnego źródła (takiego jak: bateria lub baterii) w celu wymuszenia wystąpienia reakcji chemicznej prowadzącej do wytworzenia prostych lub złożonych substancji, których nie można znaleźć w naturze lub które nie występują w dużych ilościach.
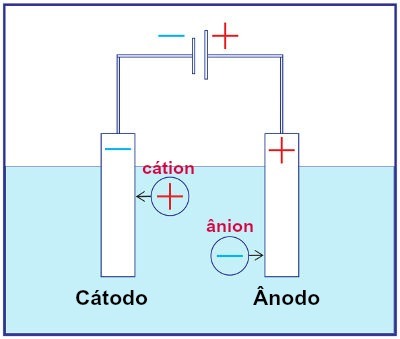
Reprezentacja montażu dowolnego systemu elektrolizy
Podczas elektrolizy kation ulega redukcji na katodzie, a anion utlenianiu na anodzie. Dzieje się to poprzez wyładowanie elektryczne dostarczane przez zewnętrzne źródło. Tak więc w elektrolizie zachodzi niespontaniczna reakcja utleniania i redukcji.
Teraz zrozum dwa sposoby, w jakie zachodzi elektroliza:
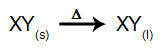
W tego rodzaju elektrolizie stosujemy a substancja jonowa w stanie ciekłym w kadzi elektrolitycznej. Gdy substancja jonowa (XY) ulega fuzji, podlega procesowi dysocjacja, jak przedstawiono poniżej:

Następnie, po włączeniu źródła zasilania, kation (X+) porusza się w kierunku katody, a aniony (Y-) przejdź w kierunku anody. A tym samym:
Na katodzie: kationy otrzymują elektrony (ulegają redukcji) i przekształcają się w substancję stabilną (X), proces ten przedstawia równanie:
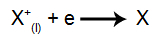
Na anodzie: aniony tracą elektrony (ulegają utlenieniu) i stają się stabilną substancją (X), co przedstawia następujące równanie:

a) Przykład elektrolizy magmowej
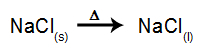
Jako przykład wykonaj teraz magmową elektrolizę chlorek sodu (NaCl). Kiedy chlorek sodu (NaCl) ulega fuzji, przechodzi proces dysocjacji, jak pokazano poniżej:
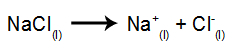
Następnie, po włączeniu źródła zasilania, kation (Na+) porusza się w kierunku katody, a aniony (Cl-) przejdź w kierunku anody. A tym samym:
Na katodzie: kationy w+ otrzymują elektrony (ulegają redukcji) i stają się stabilną substancją (Na, który jest metalem stałym), co przedstawia poniższe równanie:

Na anodzie: aniony Cl- tracą elektrony (ulegają utlenianiu) i stają się substancją stabilną (Cl2, który jest gazowy), proces reprezentowany przez poniższe równanie:

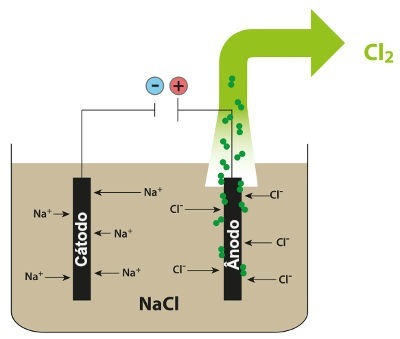
Schemat przedstawiający magmową elektrolizę NaCl
Tak więc w magmowej elektrolizie chlorku sodu powstaje metaliczny sód (Na) i gazowy chlor (Cl2).
W tego rodzaju elektrolizie wykorzystujemy substancję jonową rozpuszczoną w wodzie, wewnątrz zbiornika elektrolitycznego. Tak więc przed wykonaniem elektrolizy najpierw mieszamy substancję (najczęściej sól nieorganiczny) w wodzie, aby spowodować jej dysocjację (uwolnienie kationu i anionu), jak pokazano poniżej:
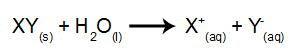
Różnica w stosunku do elektrolizy magmowej polega na tym, że oprócz jonów z dysocjacji mamy również jony z samojonizacji wody. W procesie samojonizacji woda wytwarza kation hydroniowy (H+) i anion wodorotlenkowy (OH-), jak w poniższym równaniu:

Tak więc wewnątrz kadzi elektrolitycznej mamy do czynienia z dwoma kationami (jeden z substancji) jonowy i jeden z wody) oraz dwa aniony (jeden z substancji jonowej, a drugi z Woda).
Aby wiedzieć, który kation zostanie przeniesiony do katody, a który anion do anody, konieczne jest poznanie kolejności odprowadzania kationów i anionów.
Dla kationów:
Au>Pt>Hg>Ag>Cu>Ni>Cd>Pb>Fe>Zn>Mn>hydronium>rodzina IIIA> rodzina IIA > rodzina IA
dla anionów
Aniony nieutlenione i HSO4 > wodorotlenek > utlenione aniony i F
Następnie, po włączeniu źródła zasilania, kation (X+) porusza się w kierunku katody, a jeden z anionów (Y-) przesuwa się w kierunku anody.
Na katodzie: kationy otrzymują elektrony (ulegają redukcji) i przekształcają się w substancję stabilną (X), co przedstawia poniższe równanie:

Na anodzie: aniony tracą elektrony (ulegają utlenieniu) i stają się stabilną substancją (Y), co przedstawia poniższe równanie:
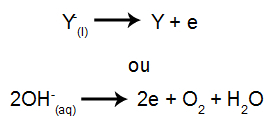
a) Przykład elektrolizy wodnej
Jako przykład posłuży nam elektroliza wodna chlorku sodu (NaCl). Gdy chlorek sodu (NaCl) rozpuszcza się w wodzie, przechodzi proces dysocjacji, jak pokazano poniżej:
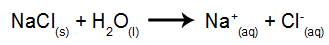
Oprócz dysocjacji NaCl mamy do czynienia z samojonizacją wody:

Więc mamy kationy H+ i dalej+ i aniony OH- i Cl-. Następnie po włączeniu źródła zasilania mamy:
na katodzie: kationy H+ odbierać elektrony (zredukowane) i stać się stabilną substancją (H2, który jest gazem). Dzieje się tak, ponieważ hydronium ma pierwszeństwo zrzutu przed pierwiastkami z rodziny IA (w tym przypadku Na). Proces przedstawia poniższe równanie:
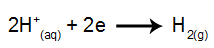
na anodzie: aniony Cl- tracą elektrony (ulegają utlenianiu) i stają się substancją stabilną (Cl2, który jest gazowy). To dlatego, że Cl the- jest anionem nieutlenionym i ma pierwszeństwo zrzutu przed wodorotlenkiem, proces ten przedstawia poniższe równanie:


Schemat przedstawiający elektrolizę wodną NaCl
Tak więc w elektrolizie wodnej chlorku sodu powstaje gazowy wodór (H2) i chloru gazowego (Cl2).
Przeze mnie Diogo Lopes Dias
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-eletrolise.htm

