Węglowodory to związki utworzone wyłącznie przez węgiel i wodór o ogólnym wzorze: CxHtak.
Jest to ogromna ilość substancji, z których najbardziej znane są składniki ropy naftowej i gazu ziemnego.
Szkielet węglowodoru składa się z węgla, a z kolei atomy wodoru wiążą się wiązaniem kowalencyjnym.
Mają szerokie zastosowanie w przemyśle chemicznym, są niezbędne do produkcji produktów ropopochodnych: m.in. paliw, polimerów, parafin.
Właściwości węglowodorów
| oddziaływanie molekularne | Są to praktycznie związki niepolarne, a ich cząsteczki łączy indukowany dipol. |
|---|---|
| Temperatura topnienia i wrzenia | Są niskie w porównaniu do związków polarnych. |
| stany agregacji |
|
| Gęstość | Mają mniejszą gęstość niż woda. |
| Rozpuszczalność | Są nierozpuszczalne w wodzie i rozpuszczalne w substancjach niepolarnych. |
| Reaktywność |
|
Klasyfikacja węglowodorów
Jeśli chodzi o formę głównego łańcucha węglowego, węglowodory dzielą się na:
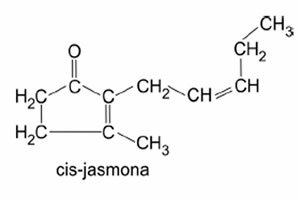
węglowodory alifatyczne
Tworzą otwarte lub acykliczne łańcuchy węglowe, które mają węgle końcowe.
- alkany
- alkeny
- Alkiny
- Alkadieny
Przykład:
Zobacz też: łańcuchy węglowe
Węglowodory cykliczne
Tworzony przez zamknięte lub cykliczne łańcuchy węglowe, które nie mają końcowych węgli.
- Cyklanie
- Cykle
- rowerzyści
- Aromaty
Przykłady:
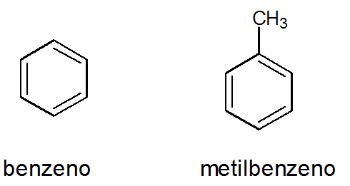
Zobacz też: benzen
Jeśli chodzi o wiązania łańcuchów węglowych, pojedyncze, podwójne lub potrójne:
Węglowodory nasycone
Związki tworzą pojedyncze wiązania między atomami węgla i wodoru.
- alkany
- Cyklanie
Przykład:
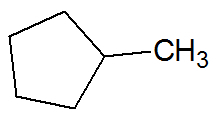
węglowodory nienasycone
Powstałe związki mają podwójne lub potrójne wiązania między atomami węgla i wodoru.
- alkeny
- Alkiny
- Alkadieny
- Cykle
- rowerzyści
- Aromaty
Przeczytaj także o:
- Wiązania chemiczne
- Chemia organiczna
- Funkcje organiczne
Nomenklatura
Nomenklaturę węglowodorów określają następujące terminy:
| PREFIKS | POŚREDNIK | PRZYROSTEK |
|---|---|---|
| Wskazuje liczbę węgli obecnych w łańcuchu. | Typ linku znaleziony w ciągu. | Identyfikacja grupy funkcyjnej. |
| PREFIKS | POŚREDNIK | PRZYROSTEK | ||
|---|---|---|---|---|
| 1C | SPOTKAŁ | Tylko jeden link | NA | O |
| 2C | ET | |||
| 3C | REKWIZYT | podwójne wiązanie | PL | |
| 4C | ALE | |||
| 5C | ZAMKNIĘTY | dwa podwójne wiązania | DIEŃ | |
| 6C | KLĄTWA | |||
| 7C | HEPT | potrójne ogniwo | W |
|
| 8C | PAŹ | |||
| 9C | NIE | Dwa potrójne ogniwa | DIIN | |
| 10C | DEC |
Przykłady
Śledź, jak powstają nazwy węglowodorów:
| Etan |
- Prefiks: ET, co odpowiada 2 węglom.
- Pośrednik: NA, co odpowiada pojedynczym linkom.
- Przyrostek: O, co odpowiada funkcji węglowodorów.
Spójrz na inne przykłady:
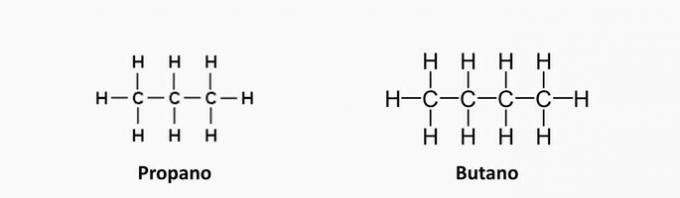
| Propan | |
| Ethene | |
| Etino | |
| propadien |
W niektórych przypadkach konieczne jest wskazanie pozycji wiązania podwójnego lub potrójnego. Numeracja musi zaczynać się od najbliższego końca tego łącza.
| 1,3-butadien | |
| 1-butyn |
Dowiedz się więcej na:
- Butan
- Metan
Rodzaje węglowodorów
Sprawdź główne rodzaje węglowodorów, ich charakterystykę oraz zastosowane związki:
alkany
Są to węglowodory o otwartym łańcuchu z pojedynczymi wiązaniami między atomami węgla i wodoru, których ogólny wzór to DONieH2n+2.
Charakterystyka alkanów
- Nazywane są również parafinami lub parafinami.
- Występują w naturze w gazie ziemnym i ropie naftowej.
- Stosowane są jako paliwa: gaz do gotowania, benzyna, olej napędowy itp.
Przykłady alkanów

alkeny
Są to węglowodory o otwartym łańcuchu i mają podwójne wiązanie, których ogólny wzór to DONieH2n.
Charakterystyka alkenów
- Nazywane są również olefinami, alkenami lub węglowodorami etylenowymi.
- Są one otrzymywane przemysłowo z krakingu alkanów obecnych w ropie naftowej.
- Są wykorzystywane jako surowiec w przemyśle: tworzywa sztuczne, barwniki, materiały wybuchowe itp.
Przykłady alkenów

Alkiny
Są to węglowodory o otwartym łańcuchu z obecnością podwójnego wiązania, których ogólny wzór to DONieH2n-2.
Charakterystyka alkinów
- Są bardziej reaktywne niż alkany i alkeny ze względu na potrójne wiązanie.
- Alkiny zawierające więcej niż 14 atomów węgla są ciałami stałymi.
- Najczęściej stosowanym alkinem jest acetylen, powszechnie stosowany w produkcji kauczuków syntetycznych, włókien tekstylnych i tworzyw sztucznych.
Przykłady alkinów

Alkadieny
Są to węglowodory o otwartym łańcuchu i obecności dwóch wiązań podwójnych, których ogólny wzór to DONieH2n-2
Charakterystyka alkadienów
- Nazywane również dienami lub diolefinami
- W naturze występują w terpenach, które są pozyskiwane z olejków eterycznych.
- Najbardziej znanym związkiem jest izopren występujący w naturalnej gumie i olejkach eterycznych.
Przykłady alkadienów

Cyklanie
Są to węglowodory o zamkniętym łańcuchu z pojedynczymi wiązaniami między atomami węgla i wodoru, których ogólny wzór to DONieH2n.
Charakterystyka cyklanu
- Nazywa się je również cykloalkanami lub cykloparafinami.
- Są niestabilne pod wpływem wysokiego ciśnienia.
- Łańcuchy zawierające więcej niż 6 atomów węgla są stabilne, podczas gdy łańcuchy zawierające mniej niż 5 atomów węgla są reaktywne.
Przykłady cyklanów

Cykle
Są to węglowodory o zamkniętym łańcuchu z obecnością podwójnego wiązania, których wzór strukturalny to DONieH2n-2.
Charakterystyka cykli
- Nazywane są również cykloalkenami.
- Związki o 3 do 5 atomach węgla są nietrwałe.
- Zazwyczaj znajdują się w gazie ziemnym, ropie naftowej i ropie naftowej.
Przykłady cyklów
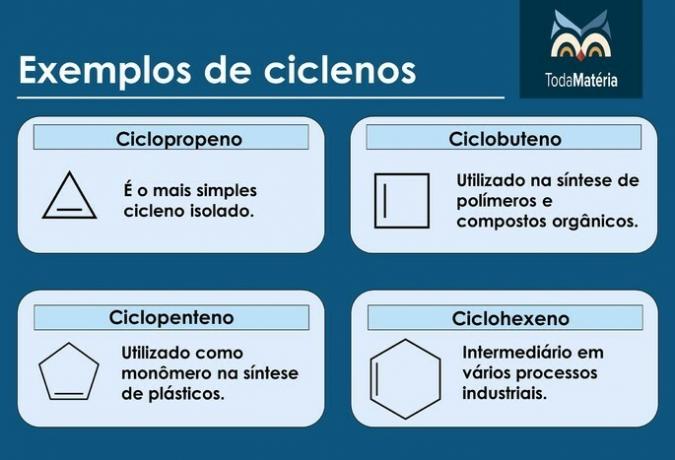
rowerzyści
Są to węglowodory o zamkniętym łańcuchu z obecnością wiązania potrójnego, których wzór strukturalny to DONieH2n-4.
Charakterystyka rowerowa
- Nazywa się je również cykloalkinami lub cykloalkinami.
- Są to węglowodory cykliczne i nienasycone.
- Są niestabilne z powodu potrójnego wiązania i nie występują w naturze.
Przykłady cyklin

Aromaty
Są to węglowodory o zamkniętym łańcuchu z naprzemiennymi wiązaniami pojedynczymi i podwójnymi.
Charakterystyka aromatów
- Nazywane są również arenami.
- Są związkami nienasyconymi, ponieważ posiadają 3 wiązania podwójne.
- Składają się z co najmniej jednego pierścienia aromatycznego.
Przykłady aromatów
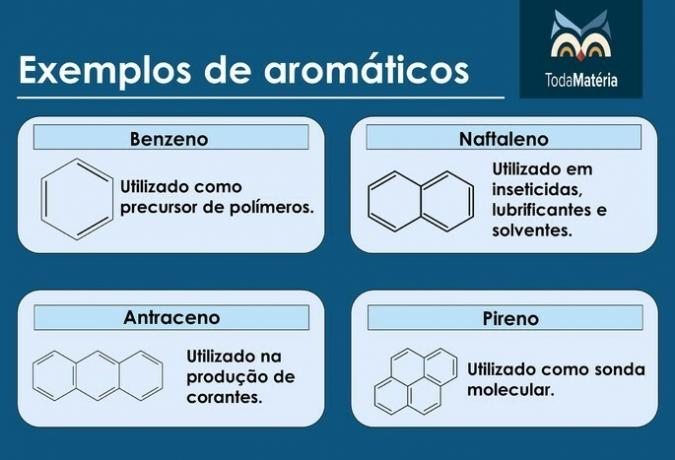
- Ropa naftowa
- rafinacja ropy naftowej
- Acetylen
Podsumowanie węglowodorów
| Zawód | Ogólna formuła |
funkcje |
|---|---|---|
| alkany | Otwarty łańcuszek z prostymi ogniwami. |
|
| alken | Otwarty łańcuszek z podwójnym wiązaniem. | |
| alkin | Otwarty łańcuch z potrójnym wiązaniem. | |
| alkadien | Otwarty łańcuszek z dwoma podwójnymi wiązaniami. | |
| Cyklanie | Zamknięty łańcuch z prostymi połączeniami. | |
| Cykle | Zamknięty łańcuch z podwójnym wiązaniem. | |
| rowerzyści | Zamknięty łańcuch z potrójnym ogniwem. | |
| Aromatyczny | Zmienna | Zamknięty łańcuch z naprzemiennymi wiązaniami pojedynczymi i podwójnymi. |
Ćwiczenia na węglowodorach
1. (UEMA) LPG (Liquefied Petroleum Gas), popularnie zwany gazem do gotowania, jest paliwem nieodnawialna skamielina, która może wyczerpać się z dnia na dzień, jeśli nie zostanie użyta z planowaniem i bez nadmiar. Składa się m.in. z propanu C3H8, butan C4H10 i małe ilości propylenu C3H6 i buten C4H8. Te związki organiczne są klasyfikowane jako węglowodory, które mają między sobą podobieństwa i różnice. Na podstawie rodzaju wiązania między węglami oraz klasyfikacji łańcucha węglowego powyższych związków można stwierdzić, że:
a) związkami nienasyconymi są propan i butan.
b) związkami nienasyconymi są propen i buten.
c) związkami nienasyconymi są propen i butan.
d) związki mają łańcuchy homocykliczne.
e) związki mają łańcuchy heterocykliczne.
Alternatywnie b) związkami nienasyconymi są propen i buten.
Źle. Związki te nie posiadają nienasyceń, ich wiązania są proste.
b) PRAWIDŁOWE. Termin „en” wskazuje na obecność wiązań podwójnych w związkach.

c) ŹLE. Butan nie ma nienasyceń.

d) ŹLE. Łańcuchy te są zamknięte, a atomy węgla połączone są wiązaniami pojedynczymi.
e) ŹLE. Łańcuchy te mają heteroatom, taki jak tlen i azot.

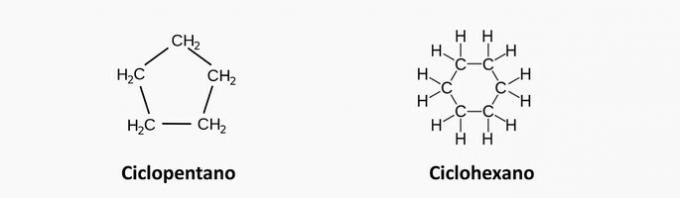
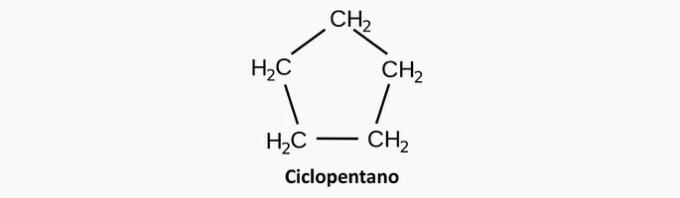
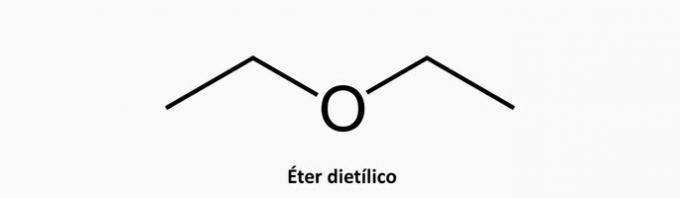
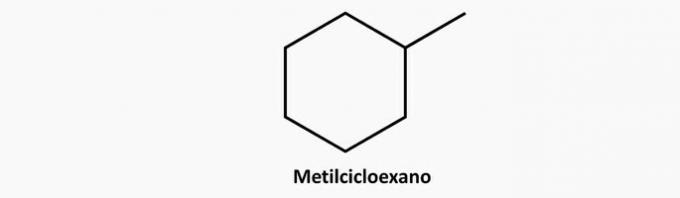
2. (Uel) Jeden z węglowodorów o wzorze C5H12 może mieć łańcuch węglowy:
a) nasycony cykliczny.
b) heterogeniczny acykliczny.
c) rozgałęziony cykliczny.
d) nienasycony otwarty.
e) otwarte rozgałęzione.
Alternatywa e) otwarta rozgałęziona.
Źle. Nasycony związek cykliczny odpowiada cyklanowi, którego wzór to CNieH2n.
Przykład:
b) ŹLE. Heterogeniczny związek acykliczny ma obecność innego pierwiastka oprócz wstawionego węgla w łańcuchu.
Przykład:
c) ŹLE. Rozgałęziony związek cykliczny ma wzór CNieH2n.
Przykład:
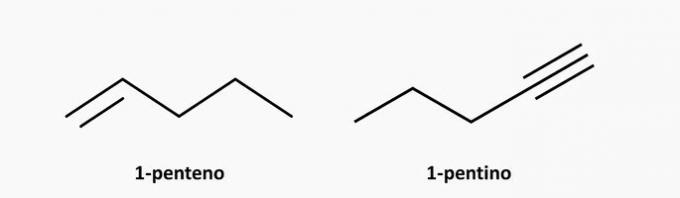
d) ŹLE. Nienasyconym związkiem o otwartym łańcuchu może być alken lub alkin, o wzorze odpowiednio C.NieH2n i CNieH2n-2.
Przykłady:
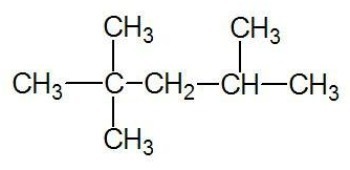
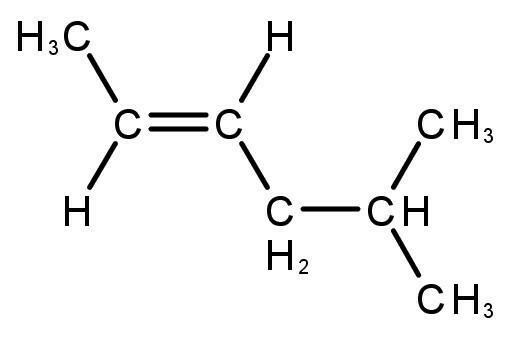
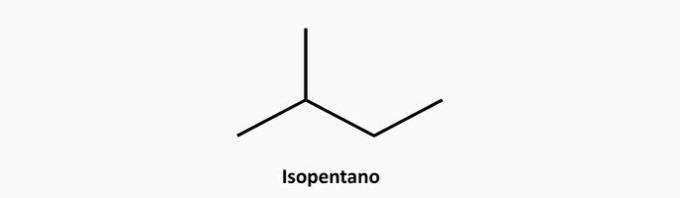
e) PRAWIDŁOWE. Rozgałęziony związek o otwartym łańcuchu to alkan o wzorze CNieH2n+2. Związek o 5 atomach węgla i 12 atomach wodoru może być izopentanem.
Przykład:
3. (PUC) Alkiny to węglowodory:
a) nasycone alifatyki.
b) nasycone alicykliczne.
c) nienasycone związki alifatyczne z podwójnym wiązaniem.
d) alicykliczne nienasycone wiązania potrójne.
e) potrójnie wiązane nienasycone alifatyki.
Alternatywa e) alifatyki nienasycone wiązanie potrójne.
Źle. Związki o otwartym łańcuchu i wiązaniach pojedynczych są alkanami.
Przykład:

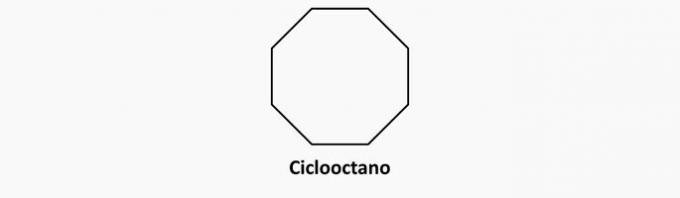
b) ŹLE. Związki cykliczne z pojedynczymi wiązaniami to cyklany.
Przykład:
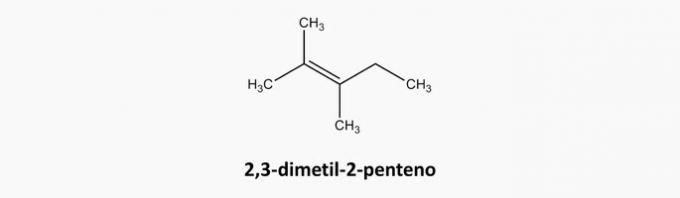
c) ŹLE. Związki o otwartym łańcuchu i podwójnie wiązane są alkenami.
Przykład:
d) ŹLE. Związki cykliczne i potrójnie związane to cykliny.
Przykład:
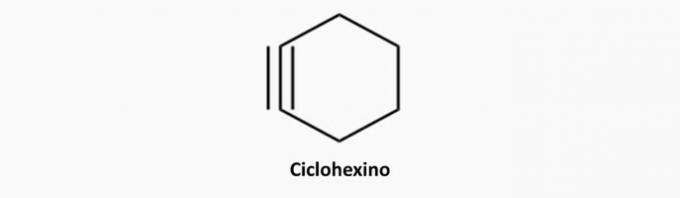
e) PRAWIDŁOWE. Alkiny są związkami otwartymi i potrójnie związanymi.

Chcesz dalej sprawdzać swoją wiedzę? Koniecznie sprawdź te listy:
- Ćwiczenia na węglowodorach
- Ćwiczenia z chemii organicznej
- Ćwiczenia z funkcji organicznych