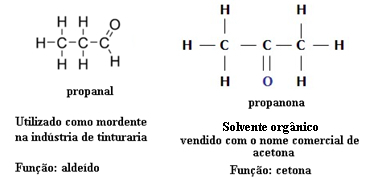
Czystą substancję tworzy jeden rodzaj substancji chemicznych, to znaczy jej skład i właściwości są stałe. Mieszanka zawiera więcej niż jeden rodzaj składnika, więc jej organizacja jest różna.
Tak więc czystą substancję od mieszaniny możemy odróżnić tylko wtedy, gdy znamy jej skład.
Porównując szklankę wody i szklankę rozpuszczonego cukru, nasze oczy nie zauważają żadnej różnicy. Jeśli jednak spożyjemy zawartość dwóch szklanek, zauważymy, że jedna jest czystą substancją, a druga składa się z mieszaniny.
czyste substancje
Czysta substancja to zestaw tylko jednego gatunku chemicznego, to znaczy nie miesza się z innymi.
Weźmy za przykład wodę. Woda (H2O) jest rozpoznawany ze względu na swoje właściwości, a specyficzne właściwości tego materiału pomagają nam go zidentyfikować. Główny właściwości wody oni są:
| Gęstość | 1,00 g/cm3 |
|---|---|
| Punkt fuzji | 0°C |
| Temperatura wrzenia | 100°C |
Gdy materiał ma stałe i niezmienne właściwości w całej swojej całości, mówimy, że jest a czysta substancja.
Gdy wsypiemy sól kuchenną, chlorek sodu (NaCl) do szklanki wody i zamieszamy, nastąpi zmiana.

Rezultatem jest produkt o gęstości pośredniej pomiędzy gęstością wody i soli. Dzieje się tak, ponieważ woda nie jest już czystą substancją i stała się Mieszać.
Próbując zamrozić tę mieszaninę, zauważysz, że temperatura topnienia będzie niższa niż 0 °C i że and również ta mieszanina nie zagotuje się w 100 ° C, więcej ciepła będzie potrzebne do odparowania tego produkt.
Czyste proste i złożone substancje
Substancje czyste klasyfikuje się jako proste, gdy w ich składzie znajdują się atomy tylko jednego pierwiastka chemicznego.
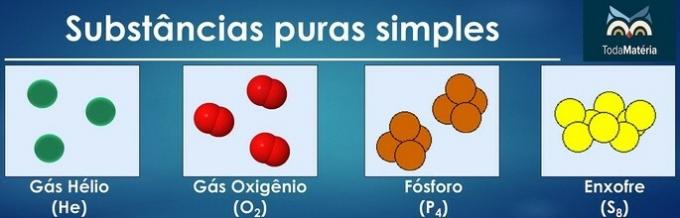
Ułożenie atomów dwóch lub więcej pierwiastków chemicznych tworzy czyste substancje złożone.

Mieszanki
Mieszanina odpowiada połączeniu dwóch lub więcej czystych substancji, które nazywane są składnikami.
W przeciwieństwie do czystych substancji jego właściwości nie są stałe, ponieważ zależą od proporcji składników w mieszaninie.
Zobacz, jak gęstość, właściwość fizyczna, zmienia się w zależności od ilości soli zmieszanej z wodą.
| Procent soli w całkowita masa mieszanki |
Gęstość mieszanki (g/cm3) w 20 °C |
|---|---|
| 1 | 1,005 |
| 8 | 1,056 |
| 12 | 1,086 |
| 16 | 1,116 |
| 26 | 1,197 |
Źródło: FURNISS, B. Św. i in. Podręcznik praktycznej chemii organicznej Vogla. 4. wyd. Londyn: Longman, 1987. str. 1.312.
Dlatego dodatek wody i soli w dowolnej proporcji ma zmienną gęstość i dlatego nie możemy zaklasyfikować mieszaniny jako wody lub soli.
Mieszaniny jednorodne i niejednorodne
Mieszaniny jednorodne to takie, które prezentują składniki tylko w jednej fazie, a zatem mają te same właściwości we wszystkich punktach.

Kiedy wizualnie dostrzegamy więcej niż jedną fazę, mieszanina jest klasyfikowana jako niejednorodna.

Podsumowanie dotyczące czystych substancji i mieszanin
| Czyste substancje i mieszaniny | |
|---|---|
|
jednorodny system (tylko jedna faza) |
czysta substancja (jeden składnik) |
|
jednorodna mieszanina (więcej niż jeden składnik w tej samej fazie) | |
|
niejednorodny system (więcej niż jedna faza) |
czysta substancja (składnik w różnych stanach fizycznych) |
|
mikstura heterogeniczna (więcej niż jeden składnik w więcej niż jednej fazie) |
Aby dowiedzieć się więcej, koniecznie sprawdź te teksty:
- Atomy
- Pierwiastki chemiczne
- Separacja mieszanin
Ćwiczenia z komentarzem zwrotnym
1. (UFMG) Próbka czystej substancji X miała określone niektóre jej właściwości. Wszystkie alternatywy mają właściwości przydatne do identyfikacji tej substancji, z wyjątkiem:
a) gęstość.
b) masa próbki.
c) rozpuszczalność w wodzie.
d) temperatura wrzenia.
e) temperatura topnienia.
Zła alternatywa: b) masa próbki.
a) PRAWIDŁOWE. Gęstość to ilość materii w danej objętości. Jako właściwość specyficzna dla materiału jest przydatna do identyfikacji substancji.
b) ŹLE. Masa to ilość materii w ciele. Ponieważ właściwość ta dotyczy każdej materii, niezależnie od jej konstytucji, nie można jej użyć do identyfikacji substancji.
c) PRAWIDŁOWE. Rozpuszczalność to zdolność substancji do rozpuszczania się lub nie w danej cieczy. Jako właściwość specyficzna dla materiału jest przydatna do identyfikacji substancji.
d) PRAWIDŁOWE. Temperatura wrzenia odpowiada temperaturze zmiany stanu ciekłego w gazowy. Jako właściwość specyficzna dla materiału jest przydatna do identyfikacji substancji.
e) PRAWIDŁOWE. Temperatura topnienia odpowiada temperaturze przejścia ze stanu ciekłego w stan stały. Jako właściwość specyficzna dla materiału jest przydatna do identyfikacji substancji.
2. (Vunesp) Poniżej przedstawiono etykietę butelki wody mineralnej.
| Prawdopodobny skład chemiczny: |
|---|
| Siarczan Wapnia 0,0038 mg/L |
| Wodorowęglan wapnia 0,0167 mg/L |
Na podstawie tych informacji możemy sklasyfikować wodę mineralną jako:
a) czysta substancja.
b) prosta substancja.
c) mieszanina niejednorodna.
d) jednorodna mieszanina.
e) zawiesina koloidalna.
Właściwa alternatywa: d) jednorodna mieszanina.
Źle. Woda byłaby czysta, gdyby w jej składzie były tylko cząsteczki H2O.
b) ŹLE. Prosta substancja składa się z atomów tylko jednego pierwiastka chemicznego. Czysta woda nie jest też prostą substancją, ponieważ składa się z atomów wodoru i tlenu (H2O) jest klasyfikowany jako złożony.
c) ŹLE. Mieszanina niejednorodna ma więcej niż jedną fazę, w tym przypadku możemy obserwować tylko wodę.
d) PRAWIDŁOWE. Ponieważ ma tylko jedną fazę, system jest jednorodny. Patrząc na butelkę z wodą, widzimy tylko płyn, ponieważ związki siarczanu wapnia i wodorowęglanu wapnia są rozpuszczalne w wodzie, a zatem rozpuszczają się.
e) ŹLE. Zawiesina koloidalna to niejednorodna mieszanina, której składniki są rozróżniane pod mikroskopem.
3. (UCDB) W laboratorium chemicznym przygotowano następujące mieszaniny:
JA. woda/benzyna
II. woda/sól
III. woda/piasek
IV. benzyna/sól
V. benzyna/piasek
Które z tych mieszanin są jednorodne?
a) Brak.
b) Tylko II.
c) II i III.
d) I i II.
e) II i IV.
Prawidłowa alternatywa: b) Tylko II.
Źle. Woda jest związkiem nieorganicznym, a benzyna związkiem organicznym. Substancje te nie mają zdolności do interakcji, a ponieważ mają różne gęstości, tworzą niejednorodną mieszaninę.
b) PRAWIDŁOWE. Sól, chlorek sodu, rozpuszcza się w wodzie tworząc roztwór, który jest jednorodną mieszaniną.
c) ŹLE. Piasek, dwutlenek krzemu, tworzy z wodą niejednorodną mieszaninę.
d) ŹLE. Sól jest związkiem nieorganicznym, a benzyna związkiem organicznym. Substancje te nie mają zdolności do interakcji, a ponieważ mają różne gęstości, tworzą niejednorodną mieszaninę.
e) ŹLE. Piasek jest związkiem nieorganicznym, a benzyna związkiem organicznym. Substancje te nie mają zdolności do interakcji i dlatego tworzą niejednorodną mieszaninę.
4. (Ufes) W dobrze wymieszanym systemie składającym się z piasku, soli, cukru, wody i benzyny liczba faz wynosi:
a) 2.
b) 3.
c) 4.
d) 5.
e) 6.
Prawidłowa alternatywa: b) 3.
FAZA 1: Sól i cukier mogą oddziaływać z wodą i poprzez siły międzycząsteczkowe cząsteczki wiążą się i tworzą roztwór, który jest jednorodną mieszaniną.
FAZA 2: Woda jest związkiem nieorganicznym, a benzyna związkiem organicznym. Substancje te nie mają zdolności do interakcji, a ponieważ mają różne gęstości, tworzą niejednorodną mieszaninę.
FAZA 3: Piasek jest krzemianem, który nie ma powinowactwa chemicznego z wodą i benzyną, a zatem stanowi fazę.
5. (Mackenzie) Mieszanina utworzona przez:
a) kostki lodu i wodny roztwór cukru (glukoza).
b) gazy N2 i CO2.
c) woda i aceton.
d) woda i syrop agrestowy.
e) nafta i olej napędowy.
Właściwa alternatywa: a) kostki lodu i wodny roztwór cukru (glukoza).
a) PRAWIDŁOWE. Można zaobserwować dwie fazy: kostki lodu i roztwór glukozy, są więc układem niejednorodnym.
b) ŹLE. Gazy są zawsze jednorodną mieszaniną.
c) ŹLE. Wiązania wodorowe tworzą się między karbonylkiem propanonu a cząsteczką wody. Ponieważ są to substancje polarne, aceton może rozpuszczać się w wodzie i tworzyć jednorodną mieszaninę.
d) ŹLE. Te dwa składniki mieszają się, tworząc jednorodny układ, ponieważ zobaczymy tylko czerwony płyn z syropu agrestowego, ponieważ rozcieńczenie następuje przez dodanie wody.
e) ŹLE. Oba są związkami organicznymi i dzięki powinowactwu chemicznemu tworzą jedną fazę, stanowiącą jednorodny układ.
Sprawdź swoją wiedzę za pomocą ćwiczeń:
- Ćwiczenia na mieszaninach jednorodnych i niejednorodnych
- Ćwiczenia z rozdzielania mieszanin
- Ćwiczenia z właściwości materii