Warstwa walencyjna jest ostatnią warstwą dystrybucji elektronowej atomu. Ponieważ jest to warstwa najbardziej zewnętrzna, jest również najdalej od jądra atomowego.
Według Reguła oktetu, powłoka walencyjna potrzebuje ośmiu elektronów do stabilizacji.
Tak więc atomy uzyskują stabilność, gdy mają 8 elektronów w powłoce walencyjnej. Dzieje się tak z gazami szlachetnymi, mają one pełną warstwę walencyjną. Jedynym wyjątkiem jest pierwiastek Hel, który ma 2 elektrony.
Pozostałe pierwiastki muszą utworzyć wiązania chemiczne, aby otrzymać brakujące elektrony i dotrzeć do ośmiu elektronów w powłoce walencyjnej.
W wiązaniach uczestniczą elektrony powłoki walencyjnej, ponieważ są one najbardziej zewnętrzne.
Warstwy elektrosfery
Zgodnie z modelem atomowym Rutherforda-Bohra elektrony krążą wokół jądra atomowego, w różnych warstwach energetycznych.
Istnieje siedem warstw oznaczonych literami K, L, M, N, O, P i Q. Każdy obsługuje maksymalną liczbę elektronów.
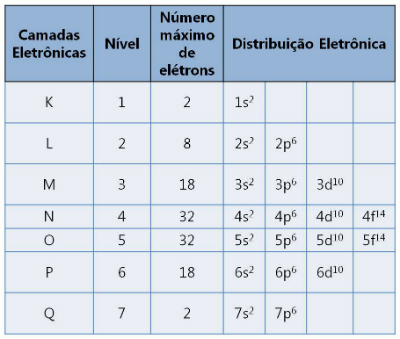 Warstwy elektroniczne i liczba elektronów, które obsługują
Warstwy elektroniczne i liczba elektronów, które obsługują
Przeczytaj też:
- Model atomowy Bohra
- Model atomowy Rutherforda
- Gazy szlachetne
- Reguła oktetu
Jak określić warstwę Walencji?
Warstwę walencyjną można określić na dwa sposoby: Dystrybucja elektroniczna i Układ okresowy pierwiastków.
Aby określić warstwę walencyjną za pomocą dystrybucji elektronicznej, Schemat Linusa Paulinga.
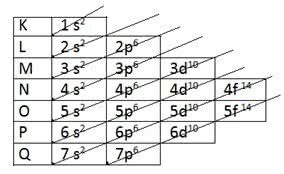 Schemat Paulinga
Schemat Paulinga
Przypomnij sobie, że diagram Paulinga podąża za rosnącym porządkiem energii. Ostatnią warstwą uzyskaną w rozkładzie elektronicznym jest warstwa walencyjna.
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Tak więc w warstwie walencyjnej najbardziej energetycznym podpoziomem jest ostatnia warstwa.
Przykłady:
Azot - N
Liczba atomowa: 7
Dystrybucja elektroniczna: 1s2 2s2 2p3
Warstwa Walencji: 2s2 2p3, N ma 5 elektronów w powłoce walencyjnej.
Żelazo - Fe
Liczba atomowa: 26
Dystrybucja elektroniczna: 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Warstwa Walencji: 4s2, Fe ma 2 elektrony w powłoce walencyjnej.
Chlor - Cl
Liczba atomowa: 17
Dystrybucja elektroniczna: 1s2 2s2 2p6 3s2 3p5
Warstwa Walencji: 3s2 3p5, Cl ma 7 elektronów w powłoce walencyjnej.
Tlen - O
Liczba atomowa: 8
Dystrybucja elektroniczna: 1s2 2s2 2p4
Warstwa Walencji: 2s2 2p4, tlen ma 6 elektronów w powłoce walencyjnej.
Węgiel - C
Liczba atomowa: 6
Dystrybucja elektroniczna: 1s2 2s2 2p2
Warstwa Walencji: 2s2 2p2, węgiel ma 4 elektrony w powłoce walencyjnej.
Przeczytaj także o Liczby kwantowe.
Do tej pory używane przykłady dotyczyły elementów stanu podstawowego. Ale ta sama zasada może być użyta do jony, kationy i aniony. Zobacz przykład:
Anion chlorkowy - Cl-
Liczba atomowa chloru to 17. Gdyby był w stanie podstawowym, liczba elektronów byłaby równa liczbie protonów. Jednak w tym przypadku następuje wzmocnienie 1 elektronu.
Najpierw wykonaj dystrybucję elektroniczną dla pierwiastka chloru:
1s2 2s2 2p6 3s2 3p5
Mając dodatkowy elektron, dodaj ostatnią warstwę:
1s2 2s2 2p6 3s2 3p6. Więc w powłoce walencyjnej jest 8 elektronów (3s2 3p6).
Zobacz też: Ćwiczenia z dystrybucji elektronicznej.
Aby określić warstwę walencyjną za pomocą układu okresowego, konieczne jest zidentyfikowanie okresu i rodziny pierwiastków.
Tak więc, podczas gdy rodzina 1A ma 1 elektron walencyjny, 2A ma 2 i tak dalej. Zawarte w nim pierwiastki chemiczne rodzina układu okresowego pierwiastków mają taką samą liczbę elektronów w powłoce walencyjnej.
Jest to jednak ważne tylko dla grup 1, 2, 13, 14, 15, 16 i 17, które mają następujące liczby elektronów w powłoce walencyjnej odpowiednio 1, 2, 3, 4, 5, 6 i 7.
W przypadku elementów, w których ta zależność nie jest możliwa, należy stosować dystrybucję elektroniczną.
Nie zapomnij! W wiązania chemiczne wynikają z potrzeby stabilizacji atomów, a tym samym tworzenia cząsteczek. Odbywa się to poprzez oddawanie elektronów z powłoki walencyjnej, które ponieważ znajdują się dalej od jądra, mają tendencję do oddawania.
Przeczytaj także o Geometria molekularna.
Ćwiczenia
1. Znajdź warstwę walencyjną następujących elementów:
Brom
35br
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
Powłoka walencyjna bromu (rodzina 7A) ma 7 elektronów. To dlatego, że 4s2 i 4p5 należą do warstwy N, natomiast 3d10 należy do warstwy M.
Aluminium
13Glin
1s2 2s2 2p6 3s2 3p1
Aluminiowa powłoka walencyjna (rodzina 3A) ma 3 elektrony.
2. (UFSC) Liczba elektronów na każdym podpoziomie atomu strontu (38Sr) w porządku rosnącym energii to:
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
b) 1s2 2s2 2p6 3s2 3p6 4s2 4p6 3d10 5s2
c) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2
d) 1s2 2s2 2p6 3s2 3p6 4p6 4s2 3d10 5s2
e) 1s2 2s2 2p6 3p6 3s2 4s2 4p6 3d10 5s2
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
3. (IFSP/2013) Liczba elektronów w powłoce walencyjnej atomu wapnia (Z = 20) w stanie podstawowym wynosi
do 1
b) 2
c) 6
d) 8
e) 10
b) 2
Sprawdź pytania egzaminacyjne z komentowanym rozwiązaniem w: Ćwiczenia z układu okresowego pierwiastków.