Halogenek to związek organiczny, który ma co najmniej jeden atom halogenu. – czyli pierwiastki chemiczne z rodziny 17 lub VII Układu Okresowego (F, Cl, Br, I lub ogólnie: X) – dołączony do grupy pochodzącej z węglowodoru.
RX (gdzie X = F, Cl, Br lub I)
Niektóre halogenki pokazano poniżej:

Jod jest najbardziej reaktywny ze wszystkich, a fluor najmniej, ponieważ energia wiązania halogenu z węglem wzrasta w kierunku od jodu do fluoru.
Inną kwestią jest to, że reaktywność również wzrasta w tym sensie:

Ta reaktywność zachodzi zatem z większą łatwością w trzeciorzędowych halogenkach węgla, ze względu na charakter nabyty przez węgiel związany z halogenkiem organicznym:

Tak więc grupa podstawnikowa, taka jak OH, która utworzy alkohol, jest silniej przyciągana do węgla trzeciorzędowego, który ma charakter dodatni (1+) i podstawienie jest łatwiejsze.
Halogenki mogą ulegać reakcjom pozwalającym uzyskać praktycznie wszystkie inne funkcje organiczne (m.in. alkohol, eter, alkin, cyjanek czy nitryl, amina). W praktyce jest to jednak niewykonalne, ponieważ halogenki są bardzo drogimi związkami.
Na przykład w celu wytworzenia alkoholu halogenek poddaje się reakcji z mocną zasadą, taką jak wodorotlenek sodu, w środowisku wodnym. Zobaczmy przykład poniżej, w którym z alkalicznej hydrolizy chlorku etylu (chloroetanu) powstanie etanol:
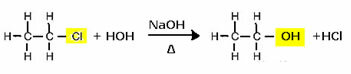
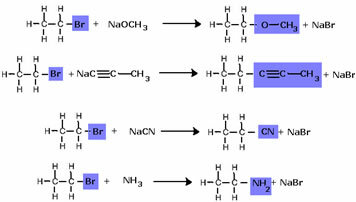
Zauważ, że grupa halogenkowa została zastąpiona przez OH, alkoholową grupę funkcyjną. Ten sam schemat stosuje się do tworzenia innych grup, różnicując tylko odczynnik:
Jennifer Fogaça
Absolwent chemii
Brazylijska drużyna szkolna
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/reacoes-substituicao-haletos-organicos.htm


