Reakcje nitrowania to reakcje substytucji zachodzące przez kwas azotowy (HNO3). Ten typ reakcji zachodzi zwłaszcza z alkanami oraz z benzenem i jego pochodnymi, gdzie jeden z atomów wodoru przyłączonych do łańcucha lub do pierścienia aromatycznego jest zastąpiony grupą NO.2, co powoduje powstanie związku nitrowego i wody.
Zobacz kilka przykładów:
1. Azotowanie alkanu:
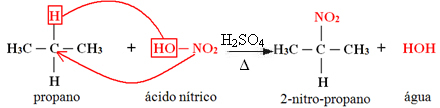
Gdy alkan ma więcej niż dwa węgle, powstaje mieszanina różnych podstawionych związków. Ilość każdego otrzymanego związku będzie proporcjonalna do następującej kolejności łatwości, z jaką wodór jest uwalniany do cząsteczki:

W powyższym przypadku nie ma węgla trzeciorzędowego, jest tylko jeden drugorzędowy i dwa pierwszorzędowe; zatem największą ilością związku utworzonego jako produkt będzie 2-nitropropan.
Jeśli jest wystarczająca ilość kwasu azotowego, inny wodór można zastąpić grupą nitrową, co daje 2-dinitropropan (struktura poniżej), związek szeroko stosowany jako dodatek do oleju napędowego, zwiększający jego liczbę oktanową i zmniejszający emisję sadza.
NA2
│
H3C─C─CH3
│
NA2
2. Nitrowanie benzenu:
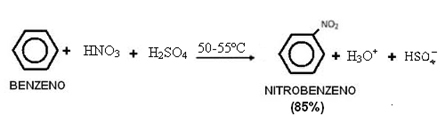
Należy zauważyć, że reakcja ta zachodzi w obecności ciepła, ponieważ benzen jest ogrzewany mieszaniną sulfonowo-wodorotlenową, tj. stężonym kwasem azotowym ze stężonym kwasem siarkowym. Kwas siarkowy jest katalizatorem, powodującym wzrost szybkości reakcji, ponieważ benzen powoli reaguje z kwasem azotowym.
3. Azotowanie pochodnych benzenu:
W takich przypadkach miejsce podstawienia będzie zależeć od grupy podstawnikowej lub grupy funkcyjnej przyłączonej do pierścienia aromatycznego. Teksty "Radykały kierujące w pierścieniu benzenowym" i "Elektroniczne efekty rodników meta i orto-dyrektorów” wyjaśnij więcej o tym, jak to się dzieje.
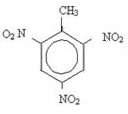
Pierścienie aromatyczne mogą ulegać nitrowaniu i powodować powstawanie materiałów wybuchowych. Przykładem jest trinitrotoluen (2-metylo-1,3,5-trinitrobenzen), lepiej znany jako TNT i istnieje kilka pigmentów stosowanych głównie w tkaninach.
Jennifer Fogaça
Absolwent chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/reacoes-organicas-nitracao.htm


