Reakcje redoks polegają na przenoszeniu elektronów między atomami, jonami lub cząsteczkami.
W reakcji utleniania-redukcji zachodzą zmiany w stopniu utlenienia (nox). Oxi-redukcja składa się z procesów utleniania i redukcji:
- Utlenianie: prowadzi do utrata elektronów i zwiększone nox.
- Zmniejszenie: prowadzi do wzmocnienie elektronów i zmniejszona nox.
Gdy jeden pierwiastek odda elektrony, inny je odbierze. Zatem całkowita liczba otrzymanych elektronów jest równa całkowitej liczbie utraconych elektronów.
Przykłady reakcji redoks na spalanie, korozję i fotosyntezę.
Przykłady
W zależności od pierwiastka, który odbiera lub oddaje elektrony, mamy następujące nazwy:
- Środek redukujący: Taki, który ulega utlenieniu powoduje redukcję i zwiększa jego liczbę nox. To właśnie traci elektrony.
- Środek utleniający: Ten, który ulega redukcji, powoduje utlenianie i zmniejsza jego liczbę nox. To właśnie zyskuje elektrony.
O liczba utlenienia reprezentuje ładunek elektryczny elementu w czasie, gdy uczestniczy w wiązanie chemiczne.
Ten stan jest związany z elektroujemność, czyli tendencja niektórych pierwiastków do przyjmowania elektronów.
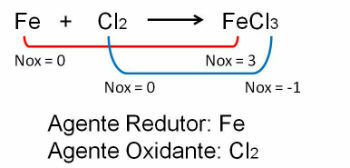
1. Zwróć uwagę na pierwszy przykład, zauważ, że w reakcji między żelazem a chlorem następuje zmiana stopnia utlenienia. O chlor będąc bardziej elektroujemnym, zyskuje elektrony:
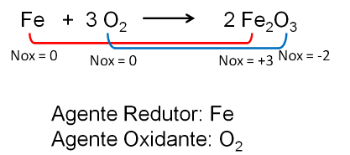
2. Reakcja między żelazem a tlenem. Tlen jest bardziej elektroujemny i ostatecznie odbiera elektrony i zmniejsza ich stopień utlenienia.
Dowiedz się więcej, czytaj też:
- Utlenianie
- Spalanie
- Reakcje chemiczne
- elektrony
Ćwiczenie rozwiązane
1. (PUC-RS) W odniesieniu do równania utleniania - niezrównoważona redukcja Fe0 + CuSO4 → Fe2(TYLKO4)3 + Cu0, można powiedzieć, że:
a) stopień utlenienia miedzi w siarczanie miedzi wynosi +1.
b) atom żelaza traci 2 elektrony.
c) miedź ulega utlenianiu.
d) żelazo jest środkiem utleniającym.
e) żelazo ulega utlenianiu.
Rozkład:
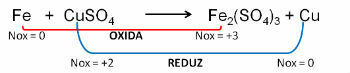
Odpowiadać:
e) żelazo ulega utlenianiu.
Ćwiczenia
1. (UFAC-AC) W następującym równaniu chemicznym: Zn + 2 HCℓ → ZnCℓ2 + H2
a) pierwiastek Zn utlenia się i reaguje jako środek utleniający.
b) pierwiastek Zn utlenia się i reaguje jako czynnik redukujący.
c) pierwiastek Zn redukuje i reaguje jako środek redukujący.
d) HCℓ jest środkiem redukującym.
e) równanie jest sklasyfikowane jako odwracalne.
b) pierwiastek Zn utlenia się i reaguje jako czynnik redukujący.
2. (ITA-SP) W reakcji jonowej Ni(s) + Cu2+(aq) → Ni2+(aq) + Cu (s)
a) nikiel jest utleniaczem, ponieważ jest utleniony.
b) nikiel jest reduktorem, ponieważ jest utleniony.
c) jon miedziowy jest utleniaczem, ponieważ jest utleniony.
d) jon miedziowy jest reduktorem, ponieważ jest redukowany.
e) nie jest to reakcja redoks, dlatego nie ma utleniacza ani reduktora.
b) nikiel jest reduktorem, ponieważ jest utleniony.
3. (UFRGS) Czynnikiem aktywnym domowego wybielacza jest jon podchlorynowy, ClO-. W procesach bielenia jon ten jest redukowany; To znaczy że:
a) substancja podlegająca działaniu podchlorynu otrzymuje elektrony.
b) w jego strukturze następuje spadek liczby elektronów.
c) ClO- jest środkiem redukującym.
d) ClO- przekształca się w chlorek pierwiastkowy lub jon chlorkowy.
e) nie zachodzi transfer elektronów.
d) ClO- przekształca się w chlorek pierwiastkowy lub jon chlorkowy.


