Układ okresowy pierwiastków to sposób na uporządkowanie wszystkich pierwiastków chemicznych według ich właściwości i przedstawienie pewnych informacji na ich temat.
W życiu codziennym organizacja jest bardzo ważna, aby ułatwić nam życie. Na przykład wyobraź sobie, że twoja szafa jest zabałaganiona, ze skarpetkami wymieszanymi z koszulami i spodniami. To byłoby bardzo trudne i zajęłoby więcej czasu, aby znaleźć konkretną skarpetkę, którą chcesz nosić, prawda?! Ale jeśli zorganizujesz swoją garderobę i umieścisz wszystkie skarpetki w jednej szufladzie, miej szufladę. na t-shirty, inny na szorty i tak dalej, znacznie łatwiej będzie znaleźć to, co potrzeba. A im więcej posiadasz ubrań, tym więcej potrzebujesz organizacji.
Podobnie naukowcy z biegiem czasu odkrywali wiele pierwiastków chemicznych. Aby dać wam wyobrażenie, w 1850 r. znanych było około 60 pierwiastków, ale dziś wiemy o istnieniu 118. W związku z tym pojawiła się potrzeba uporządkowania tych pierwiastków chemicznych w sposób ułatwiający zrozumienie ich właściwości. To jest rola układu okresowego pierwiastków chemicznych.
Układ okresowy pierwiastków, którego używamy dzisiaj, jest ułożony w poziome linie w porządku rosnącym liczby atomowej.
Powinieneś zapoznać się z układem okresowym tak, jakbyś czytał normalny tekst, czyli zawsze zaczyna się od pierwszego rzędu i od lewej strony do prawej, a następnie przechodzi w dół do następnego linie.Pierwiastki chemiczne zostały umieszczone w układzie okresowym w oddzielnych kwadratach, gdzie symbol pierwiastka znajduje się w połowa i wartość liczby atomowej jest zwykle zapisywana na górze, jak pokazano w poniższym przykładzie wodoru:

Symbol wodoru i jego liczba atomowa, jak pokazano w układzie okresowym
Liczba atomowa to ilość protonów lub ładunków dodatnich, jakie mają atomy pierwiastka. Ta wartość jest równa liczbie elektronów, gdy atom znajduje się w stanie podstawowym.Wodór to pierwiastek, który ma tylko 1 proton, czyli jego liczba atomowa wynosi 1. Dlatego wodór jest pierwszym pierwiastkiem umieszczonym w tabeli. Kolejnym pierwiastkiem znajdującym się na tej samej linii co wodór jest hel, ponieważ ma on liczbę atomową równą 2.
Przechodząc do dolnego rzędu, pierwszy to Lit o liczbie atomowej równej 3, obok jest beryl o liczbie atomowej 4 i tak dalej.Spójrz na pierwsze wiersze układu okresowego pokazanego poniżej i zobacz, że kolejność liczby atomowej rośnie dokładnie.
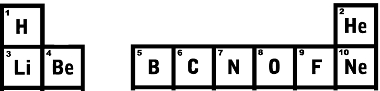
Pierwsze dwie linie układu okresowego pierwiastków
W układzie okresowym jest siedem linii, które nazywają się okresy. Popatrz:

Okresy w układzie okresowym
Istnieje 18 kolumn, które nazywają się rodziny lub grupy. Ważnym aspektem jest to, że pierwiastki należące do tej samej rodziny to te, które mają podobne właściwości fizyczne i chemiczne.

Rodziny lub grupy układu okresowego pierwiastków
Zobaczmy, czy rozumiesz? Powiedz mi, jaki jest pierwiastek chemiczny należący do 4. okresu i 16. rodziny?
Jeśli powiedziałeś Se (selen), masz rację! A teraz powiedz mi, jaka jest jego liczba atomowa. Zgadza się, to 34.
W każdym małym kwadracie, który widzi element, znajdują się również inne ważne informacje, takie jak masa atomowa i elektrony które znajdują się w każdej warstwie elektronicznej atomów. Na przykład zobacz na poniższym obrazku, że neon ma Ne jako symbol, jego liczba atomowa jest równa 10, jego masa atomowa jest równa 20.1797 u, a jego elektrony są rozłożone w ten sposób w swoich warstwach: 2 - 8, czyli w warstwie najbliżej jądra są dwa elektrony, a w najdalszej jest osiem elektrony.

Neonowy symbol w układzie okresowym i jego atom
Teraz zwróć uwagę na dwa interesujące aspekty: (1) neon ma tylko dwie orbity lub warstwy, w których znajdują się twoje elektrony, dlatego zajmuje II tercję (druga linia);i (2) ma osiem elektronów na ostatniej warstwie, dlatego on czy rodzina 18.
To pokazuje nam, co następuje:
* Pierwiastki znajdujące się w tym samym okresie układu okresowego mają taką samą ilość warstw elektronicznych i mogą mieć maksymalnie siedem;
* Pierwiastki chemiczne należące do tej samej rodziny w układzie okresowym mają taką samą liczbę elektronów w ostatniej powłoce elektronowej:
*Rodzina 1: mieć wszystko 1 elektron w ostatniej warstwie elektronicznej;
*Rodzina 2: mieć wszystko 2 elektrony w ostatniej warstwie elektronicznej;
*Rodzina 13: mieć wszystko 3 elektrony w ostatniej warstwie elektronicznej;
*Rodzina 14: mieć wszystko 4 elektrony w ostatniej warstwie elektronicznej;
*Rodzina 15: mieć wszystko 5 elektronów w ostatniej warstwie elektronicznej;
*Rodzina 16: mieć wszystko 6 elektronów w ostatniej warstwie elektronicznej;
*Rodzina 17: mieć wszystko 7 elektronów w ostatniej warstwie elektronicznej;
*Rodzina 18: mieć wszystko 8 elektronów w ostatniej warstwie elektronicznej.
Niektóre grupy lub rodziny w układzie okresowym mają określone nazwy, zobacz niektóre:
Rodzina 1: Metale alkaliczne;
Rodzina 2: Metale ziem alkalicznych;
Rodzina 16: Chalkogeny;
Rodzina 17: halogeny;
Rodzina 18: Gazy szlachetne.

Organizacja rodzin układu okresowego pierwiastków
Ponownie sprawdźmy swoją wiedzę. Odpowiedz na następujące pytania po prostu zaglądając do układu okresowego:
1- Jak nazywa się rodzina chlorów?
2- Jaka jest jego liczba atomowa i jej masa atomowa?
3- Ile warstw elektronicznych ma atom chloru?
4- Ile elektronów ma atom chloru w swojej ostatniej powłoce elektronowej?
Odpowiedzi:
1- Halogeny (rodzina 17).
2- Liczba atomowa chloru wynosi 17, a jego masa atomowa wynosi 35,45 u.
3- Atom chloru ma trzy warstwy elektronowe, ponieważ należy do III okresu Tabeli.
4- Atom chloru ma siedem elektronów w powłoce walencyjnej, ponieważ należy do rodziny 17.
Są jeszcze inne ważne informacje, które przekazuje nam układ okresowy pierwiastków, o których będziemy mówić lepiej w późniejszych tekstach. Ale te omówione tutaj są głównymi, aby zacząć rozumieć, jak zorganizowane są w nim elementy. Pamiętaj, że stół nie jest przeznaczony do dekoracji, ale musisz go dobrze znać, aby móc się do niego odnieść w razie potrzeby.
Jennifer Fogaça
Absolwent chemii
Skorzystaj z okazji, aby sprawdzić nasze zajęcia wideo związane z tematem: