Węglowodory, zwane również węgliki wodoru, to związki organiczne, których skład ma tylko atomy węgiel (C) i od wodór (H), mając zatem ogólny wzór CxHtak.
Węglowodór składa się ze struktury węglowej, z którą wiążą się atomy wodoru wiązanie kowalencyjne.
Jest najważniejszym związkiem w chemii organicznej.
Wszystkie rodzaje węglowodorów łatwo się utleniają, uwalniając w ten sposób ciepło. Większość z nich nie jest rozpuszczalna w wodzie.
Węglowodory naturalne to związki chemiczne powstające wewnątrz Ziemi (ponad 150 km od km głębokości) przy wysokim ciśnieniu i dotrzeć do stref niższego ciśnienia poprzez procesy geologiczne.
Gdzie znajdują się węglowodory?
Głównym źródłem węglowodorów jest ropa. Z tego powodu węglowodór występuje w kilku pochodnych, takich jak nafta oczyszczona, parafina, gazu ziemnego, Benzyna, Wazelina, olej napędowy, LPG (Ciekły gaz z ropy naftowej), polimery (takich jak plastik i guma), m.in.
Ten związek organiczny stanowi 48% matrycy energetycznej Brazylii.
Łańcuch węglowy stanowiący część składu węglowodoru to czterowartościowy, czyli może wykonać cztery połączenia.
Węgiel może wiązać się z innymi atomami węgla i wodorami poprzez proste linki, debel lub trójki.
Klasyfikacja węglowodorów
Klasyfikacja węglowodorów opiera się na trzech specyfikach: a Formularz głównego łańcucha węglowego, Znajomości łańcuchów węglowych, obecność rodników alkilowych w łańcuchu węglowym i obecność heteroatomów dzieląc łańcuch węglowy.
dowiedz się więcej o wodór.
Główny kształt łańcucha węglowego
Ze względu na kształt głównego łańcucha węglowego klasyfikację węglowodorów dzieli się na: alifatyczny i cykliczny.
Sprawdź, z czego składa się każda z tych form łańcucha węglowego.
węglowodory alifatyczne
Węglowodory alifatyczne tworzą łańcuchy węglowe otwarty lub acykliczny. W tych łańcuchach węgle są końcówkami.
Przykłady:
alkany
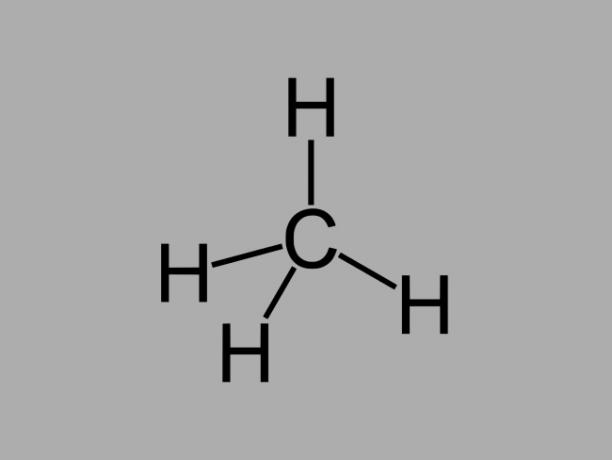
Węglowodory alkanowe, zwane również parafiny lub parafinowy, to związki oleiste, w których między węglami występują tylko pojedyncze wiązania.
Ogólny wzór alkanu to CNieH2Nie + 2 (n = dowolna liczba całkowita).
alken
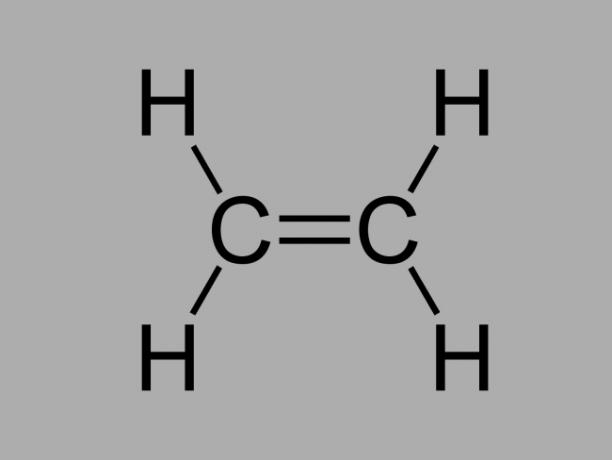
Nazywany również olefina, alken lub węglowodór etylenowy, alken jest słabo reaktywnym związkiem, w którym między węglami występuje podwójne wiązanie.
Ogólny wzór na alken to CNieH2Nie.
alkin
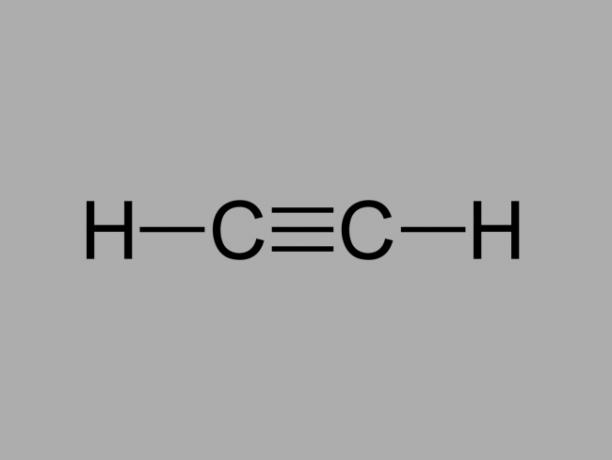
Nazywany również metyloacetylenalkin jest węglowodorem, w którym istniejące wiązania między węglami są potrójne.
Ogólny wzór na alkin to CNieH2Nie-2.
alkadien

Nazywane również dienami lub diolefinami, alkadieny to węglowodory, w których wiązania między węglami są podwójne.
Ogólny wzór na alkadien to CNieH2Nie-2.
Węglowodory cykliczne
Węglowodory cykliczne tworzą zamknięte lub cykliczne łańcuchy węglowe. Te łańcuchy nie mają końcowych węgli.
Przykłady:
Cyklan
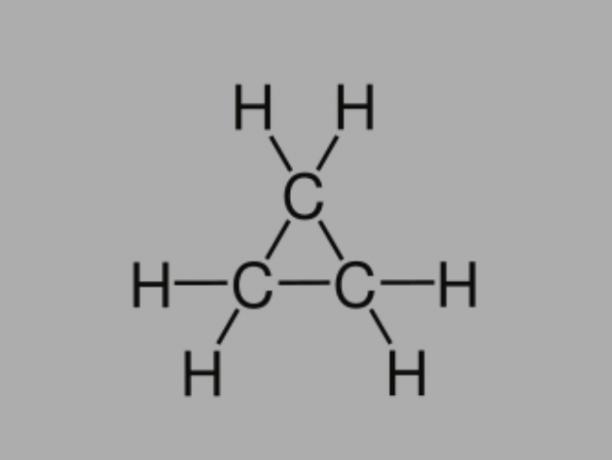
Nazywany również cykloalkan, cykloparafina lub węglowodór naftenowy, cyklan jest węglowodorem nasyconym, złożonym z pojedynczych wiązań.
Ma zamknięty łańcuch węglowy, a jego ogólny wzór to CNieH2Nie.
Cykloniczny

Nazywany również cykloalkeny, cyklony to węglowodory nienasycone, złożone z wiązań podwójnych.
Cyklen ma zamknięty łańcuch węglowy, a jego ogólny wzór to CNieH2Nie−2.
rowerzysta
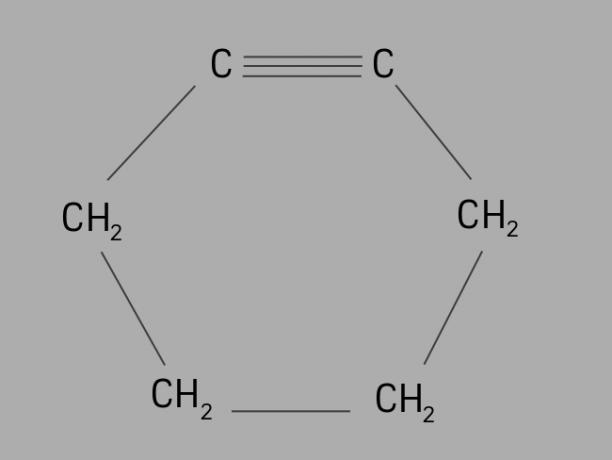
Nazywany również cykloalkin lub cykloalkin, cyklina jest węglowodorem cyklicznym i nienasyconym.
Tworzy go zamknięty łańcuch węglowy z potrójnymi wiązaniami, a jego ogólny wzór to CNieH2Nie-4.
Aromatyczny

lub

Nazywany również areny, węglowodory aromatyczne są związkami nienasyconymi utworzonymi przez wiązania podwójne.
Aromatyczny ma zamknięty lub cykliczny łańcuch węglowy, a jego ogólny wzór to C6H6.
Rodzaj wiązania łańcuchów węglowych
W zależności od rodzaju połączenia łańcuchów węglowych węglowodory można podzielić na: nasycony lub nienasycony.
Zobacz poniżej, z czego składa się każda z tych klasyfikacji.
Węglowodory nasycone
Węglowodory nasycone są tworzone przez proste linki.
Przykłady: alkany, cyklany.
węglowodory nienasycone
Węglowodory nienasycone są tworzone przez podwójne wiązania lub trójki.
Przykłady: alkeny, alkiny, alkadieny.
Obecność rodników alkilowych
Jeśli chodzi o obecność rodników alkilowych, węglowodory mogą mieć łańcuch węglowy normalna lub rozgałęziony.
normalny łańcuch węglowy
Węglowodór o normalnym łańcuchu węglowym nie zawiera rodników alkilowych.
Przykład: pentan
rozgałęziony łańcuch węglowy
Gdy węglowodór ma rozgałęziony łańcuch węglowy, oznacza to, że jego główny łańcuch węglowy zawiera rodniki alkilowe.
Przykład: metylopropan
Obecność heteroatomów dzielących łańcuch węglowy
Sekwencyjny łańcuch węglowy może, ale nie musi być rozszczepiony w zależności od obecności heteroatomów.
Jednorodny łańcuch węglowy
Gdy węglowodór ma jednorodny główny łańcuch węglowy, oznacza to, że ten łańcuch nie jest podzielony przez heteroatomy.
Heterogeniczny łańcuch węglowy
Jeśli węglowodór ma heterogeniczny główny łańcuch węglowy, ten łańcuch ma swój rozszczepiony łańcuch węglowy przez heteroatom.
Nomenklatura węglowodorów
Nomenklatura węglowodorów jest definiowana poprzez połączenie trzech części:

Przedrostek określa ilość węgli, związek pośredni określa rodzaj wiązania, a przyrostek wskazuje funkcję, do której należy dany związek (w tym przypadku klasę węglowodorów).
Zobacz poniżej listę przedrostków i półproduktów, które są połączone w celu oznaczenia węglowodorów.
Lista prefiksów
| Liczba węgli | Prefiks |
|---|---|
| 1 | Spotkał- |
| 2 | Et- |
| 3 | Rekwizyt- |
| 4 | Ale- |
| 5 | zamknięty- |
| 6 | Klątwa- |
| 7 | Hept- |
| 8 | Październik- |
| 9 | Nie- |
| 10 | Dec- |
Lista pośredników
| Rodzaj połączenia | Pośrednik |
|---|---|
| Tylko pojedyncze połączenia | -na- |
| Para | -pl- |
| potroić | -w- |
| dwie pary | -dien- |
Spójrz na kilka przykładów nazewnictwa węglowodorów.
Przykłady:
CH3 – CH2 – CH2 – CH3
W powyższej formie strukturalnej możemy zobaczyć związek 4-węglowy, który ma tylko pojedyncze wiązania (wskazane symbolem „–”).
- Prefiks dla 4 węgli = ale-
- Pośredni dla pojedynczego wiązania= -an-
- Sufiks węglowodoru= -o
Zobacz, że związek przedrostek + pośredni + przyrostek daje początek nazwie BUTAN.
CH2 = CH2
Powyższa forma strukturalna ma 2 węgle i 1 podwójne wiązanie (oznaczone symbolem „=”).
- Prefiks dla 2 węgli = et-
- Pośredni dla wiązań podwójnych= -en-
- Sufiks węglowodoru= -o
Zobacz, że związek przedrostek + pośredni + przyrostek daje początek nazwie ETEN.
CH2 = CH - CH2 – CH3
CH3 – CH = CH2 – CH3
Zauważ, że obie powyższe formy strukturalne mają 4 węgle i 1 podwójne wiązanie (oznaczone symbolem „=”).
Mamy więc:
- Prefiks dla 4 węgli = ale-
- Pośredni dla wiązań podwójnych= -en-
- Sufiks węglowodoru= -o
Zobacz, że związek przedrostek + pośredni + przyrostek dałoby początek nazwie BUTYN dla dwóch form konstrukcyjnych.
Należy jednak pamiętać, że formy strukturalne nie są identyczne, więc nomenklatury również nie mogą być.
Różnica między tymi dwiema formami strukturalnymi polega na umiejscowieniu wiązania podwójnego.
W tym przypadku musimy ponumerować węgle w łańcuchu od końca najbliższego podwójnemu. Dlatego w omawianych przypadkach musimy numerować od lewej do prawej.
W CH2 = CH - CH2 – CH3:
- CH2 będzie 1
- CH będzie 2
- CH2 będzie 3
- CH3 będzie 4
Zauważ, że podwójne wiązanie jest między węgiel 1 to jest węgiel 2.
Aby znaleźć wiązanie podwójne, musimy użyć najmniejszej liczby (1): BUTEN -1
W CH3 – CH = CH2 – CH3:
- CH3 będzie 1
- CH będzie 2
- CH2 będzie 3
- CH3 będzie 4
Zauważ, że podwójne wiązanie jest pomiędzy węgiel 2 to jest węgiel 3.
Aby znaleźć wiązanie podwójne, musimy użyć najmniejszej liczby (2): BUTEN -2
Według IUPAC (Międzynarodowe Zrzeszenie Chemii Czystej i Stosowanej – Międzynarodowa Unia Chemii Czystej i Stosowanej), lokalizację należy wskazać nieco przed znajduje się (w przypadku formalów strukturalnych powyżej, wiązanie podwójne, reprezentowane przez związek pośredni „-pl-”).
W związku z tym mamy do czynienia z drugim sposobem, nawiasem mówiąc, najbardziej poprawnym, pisania nomenklatury dostępnych form konstrukcyjnych.
CH2 = CH - CH2 – CH3: BUTEN -1 lub BUT-1-ENO (bardziej poprawna forma)
CH3 – CH = CH2 – CH3: BUTEN -2 lub BUT-2-EN (bardziej poprawna forma)
Dowiedz się więcej o IUPAC i nomenklatura.

