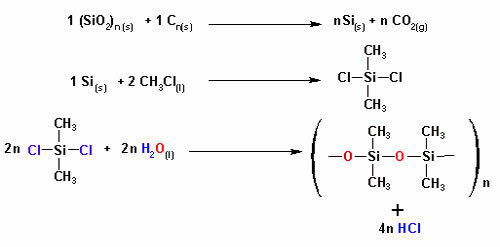
Jak wyjaśniono w tekście „Rodzaje sił międzycząsteczkowych”, cząsteczki substancji w trzech stanach skupienia (stałym, ciekłym i gazowym) są przyciągane przez jedną z sił międzycząsteczkowych.
Trzy znane siły międzycząsteczkowe to: dipol indukowany - dipol indukowany, dipol permanentny - dipol permanentny i wiązanie wodorowe. Wśród nich najsilniejsze jest wiązanie wodorowe. Niektórzy autorzy zwykli określać tę siłę międzycząsteczkową jako wiązania wodorowe; jednak właściwym terminem przyjętym przez IUPAC jest „wiązanie wodorowe”.
Ten rodzaj interakcji występuje, gdy cząsteczka ma wiązanie wodorowe z fluorem, azotem lub tlenem, które są atomami silnie elektroujemnymi.

Wiązanie wodorowe jest skrajnym przykładem trwałego wiązania dipol-stały dipol. Albowiem wodór cząsteczki stanowi biegun dodatni, który łączy się z jednym z tych atomów fluoru, tlenu lub azotu innej cząsteczki, które stanowią jej biegun ujemny.
Zwykle wiązania międzycząsteczkowe występują z substancjami w stanie ciekłym i stałym. Ponadto, ponieważ jest to bardzo intensywna siła przyciągania, jej złamanie wymaga bardzo dużej energii.
Substancją, która ma tę siłę międzycząsteczkową, jest sama woda. Zwróć uwagę, jak to się dzieje na poniższej ilustracji:

Zauważ, że każda cząsteczka wody jest przestrzennie otoczona przez cztery inne cząsteczki wody z wiązaniami wodoru powstają przez wiązanie wodoru jednej cząsteczki (biegun dodatni) z tlenem innej cząsteczki (biegun negatywny).
Wiązania wodorowe wyjaśniają różne zjawiska w przyrodzie, patrz następujące przykłady:
- Fakt, że lód unosi się na wodzie: Lód jest mniej gęsty niż woda i dzięki temu unosi się na nim. Dzieje się tak, ponieważ podczas gdy w stanie ciekłym wiązania wodorowe występujące między cząsteczkami wody są ułożone w niezorganizowany kształt, wiązania wodorowe w Cząsteczki lodu są bardziej rozmieszczone i zorganizowane, tworząc sztywną strukturę heksagonalną, co sprawia, że molekuły zajmują znacznie większą przestrzeń niż gdyby były w stanie. ciekły.

Teraz nie przestawaj... Po reklamie jest więcej ;)
Dlatego nawet jeśli włożymy wodę do pełnej objętości butelki i włożymy ją później do chłodziarki, jej objętość wzrośnie i butelka pęknie.
Będzie więc taka sama ilość cząsteczek na jednostkę objętości, co zmniejszy gęstość, zgodnie ze wzorem na gęstość: d = m/v. Pomiędzy uformowanymi sześciokątami pojawią się puste przestrzenie, zmniejszające gęstość tej substancji.
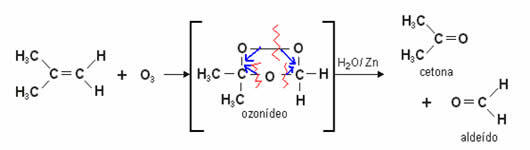
- Jonizacja kwasowa: Chociaż wiązania wodorowe są około dziesięć razy słabsze niż wiązania kowalencyjne; w pewnych okolicznościach udaje im się zerwać wiązania kowalencyjne. Na przykład w przypadku pokazanym poniżej kwas solny rozpuszcza się w wodzie. Tlen w wodzie przyciąga wodór związany z chlorem kwasu bardziej niż sam chlor, powodując powstawanie jonów hydroniowych (H3O+) i chlorek (Cl-). Zjawisko to nazywa się jonizacją:

- Napięcie powierzchniowe wody: cząsteczki na powierzchni cieczy są przyciągane przez wiązania wodorowe tylko z cząsteczkami z boku i poniżej, ponieważ powyżej nie ma cząsteczek. Z drugiej strony cząsteczki znajdujące się pod powierzchnią wykonują ten rodzaj wiązania z cząsteczkami we wszystkich kierunkach, w wyniku powstaje na powierzchni wody swego rodzaju błona lub cienka warstwa, która obejmuje.

Tłumaczy to fakt, że mogą na niej przebywać owady, a także zjawisko kulistego kształtu kropel wody.

Jennifer Fogaça
Absolwent chemii
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
FOGAÇA, Jennifer Rocha Vargas. "Wiązania wodorowe"; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/ligacoes-hidrogenio.htm. Dostęp 27 czerwca 2021 r.
Chemia

Zanieczyszczenie wody, fizyczne aspekty wody, chemiczne aspekty wody, biologiczne aspekty wody, odpady przemysłowe, metale ciężkie, woda pitna, materia organiczna, zmętnienie wody, ścieki.