“Wiązanie chemiczne” to termin użyty po raz pierwszy przez Gilberta Newtona Lewisa w roku 1920 w artykule wyjaśniającym, dlaczego że atomy sklejają się, tworząc substancje, a także dlaczego sklejają się w tysiącach over lat.
Atomy większości dotychczas znanych i wymienionych w układzie okresowym pierwiastków chemicznych nie występują w przyrodzie w postaci wyizolowanej. Większość materiałów obecnych w naszym codziennym życiu to substancje, które mogą być proste (składające się z atomów) tylko jednego rodzaju pierwiastka chemicznego) lub kompozytów (mają atomy dwóch lub więcej pierwiastków chemicznych) wiele różnych).
Dzieje się tak, ponieważ atomy mają zdolność tworzenia wiązań chemicznych z innymi atomami, które mogą być tym samym pierwiastkiem lub różnymi pierwiastkami. Wiązania te są tak silne, że bez żadnego wpływu zewnętrznego, w większości przypadków atomy pozostaną połączone tak, jak są.
Mapa myśli: wiązania chemiczne

*Aby pobrać mapę myśli w formacie PDF, Kliknij tutaj!
Na przykład nie jest powszechne znalezienie wolnego atomu tlenu w przyrodzie; jednak znajdujemy kilka substancji, w których wydaje się, że jest związany z innymi atomami. Przykładem prostej substancji jest gazowy tlen, w którym każda cząsteczka składa się z dwóch związanych atomów tlenu (O
2); natomiast przykładem substancji złożonej jest woda, w której każda cząsteczka ma dwa atomy wodoru związane z atomem tlenu (H2O).Jedynymi elementami, które są stabilnie izolowane w przyrodzie, są Gazy szlachetne, czyli elementy rodziny 18 układu okresowego (He, Ne, Ar, Kr, Xe i Rn). Wszystkie te pierwiastki łączy fakt, że mają osiem elektronów w ostatniej powłoce elektronowej (warstwie walencyjnej), z wyjątkiem helu (He), który ma tylko jedną powłokę elektronową (warstwę K), a zatem zawiera dwa elektrony, co jest maksymalną możliwą liczbą elektronów w tym warstwa.
Tak więc Gilbert N. Lewis i naukowiec Water Kossel doszli do wniosku, że atomy pozostałych pierwiastków wiążą się, aby mieć osiem elektronów (lub dwa, jeśli masz tylko powłokę K) i w ten sposób stabilizują się. Powstał wtedy, elektroniczna teoria walencji, który wskazuje, ile wiązań chemicznych tworzy atom pierwiastka, na podstawie wyjaśnionego pomysłu.
Teraz nie przestawaj... Po reklamie jest więcej ;)
W związku z tym, atomy tworzą wiązania chemiczne, dążąc do utraty, zyskania lub współdzielenia elektronów powłoki walencyjnej, dopóki nie osiągną konfiguracji następnego gazu szlachetnego.Ta teoria również została nazwana reguła oktetu.
Na przykład tlen jest dwuwartościowy, ponieważ ma sześć elektronów w powłoce walencyjnej. Dlatego musi otrzymać jeszcze dwa elektrony, aby mieć konfigurację neonu gazu szlachetnego (Ne), czyli z ośmioma elektronami w powłoce walencyjnej, która w tym przypadku jest powłoką L. W przypadku wspomnianego tlenu i wody mamy do czynienia z:
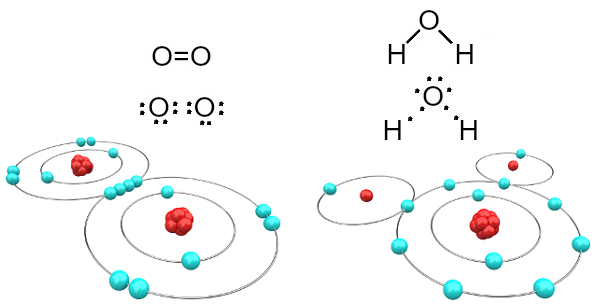
Cząsteczki tlenu i wody utworzone przez wiązania kowalencyjne
Zauważ, że w pierwszym przypadku (gaz tlenowy - O2), każdy atom tlenu dzieli dwa elektrony, z których oba mają osiem elektronów w powłoce walencyjnej. Oznacza to, że a podwójne wiązanie (dwa wiązania jednocześnie między dwoma atomami).
W przypadku wody każdy z dwóch atomów wodoru dzieli elektron z centralnym atomem tlenu i wszystkie są stabilne (tlen ma osiem elektronów w powłoce walencyjnej, a każdy wodór ma dwa elektrony). Tutaj również powstają dwa proste połączenia.
Ten rodzaj wiązania chemicznego, w którym wszystkie atomy muszą otrzymać elektrony (wodór, niemetale i półmetale) i w którym elektrony są dzielone parami, nazywa się wiązanie kowalencyjne.
Ale są jeszcze dwa rodzaje wiązań chemicznych:
(1) wiązanie jonowe → następuje definitywny transfer elektronów z jednego atomu do drugiego. Ten rodzaj wiązania występuje między atomami metali (które mają tendencję do utraty elektronów, aby pozostać) stabilne) oraz atomy wodoru, niemetale i półmetale (które mają tendencję do pozyskiwania elektronów, aby pozostać) stabilny).
Przykładem jest chlorek sodu (NaCl - sól kuchenna), w którym sód jest metalem mającym tendencję do utraty elektronu, a chlor jest niemetalem mającym tendencję do pozyskiwania elektronu. W ten sposób sód jest darowany(czerwona strzała)elektron do chloru, tworząc sól, bardzo stabilną substancję. Odkąd ukończyli szkołę (czarna Strzała) jony, które są indywiduami chemicznymi o przeciwnych ładunkach (+ i -), jeden jon przyciąga inny w pobliżu i tworzą się klastry jonowe z ogromną liczbą jonów, podobnie jak kryształy soli kuchennej.

Tworzenie chlorku sodu przez wiązanie jonowe
(2) Połączenie metalowe → Jest to teoria, że metale (takie jak aluminium, złoto, srebro, miedź itp.) są tworzone przez skupisko atomów neutronów i kationy, które są utrzymywane razem przez rodzaj „chmury” swobodnych elektronów (elektronów, które zostały utracone podczas tworzenia kationów cytowane). Ta chmura (lub morze) elektronów działałaby jak metaliczne wiązanie, które trzymałoby atomy razem.
Aby uzyskać więcej informacji na temat tego typu wiązań chemicznych, a także zasady oktetu, przeczytaj powiązane artykuły poniżej.
Mapa myśli autorstwa M.e Victor Ricardo Ferrreira
Nauczyciel chemii
Jennifer Fogaça
Absolwent chemii
Chemia

Wiązanie jonowe, układy między związkami jonowymi, aglomeraty jonowe, chlorek sodu, sól kuchenna, substancja jonowa, siły przyciągania elektrostatycznego, aniony chlorkowe, kationy sodu, rozpuszczalniki polarne, jony dodatnie, kationy, jony ujemne, aniony.

