Izomeria jest to zjawisko naturalne, w którym różne substancje (pod względem właściwości chemicznych i fizycznych) mają dokładnie taki sam wzór cząsteczkowy, jak w poniższym przykładzie:
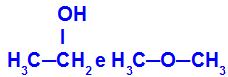
Różne substancje o tym samym wzorze cząsteczkowym
Etanol (po lewej) ma wzór cząsteczkowy C2H6O, który występuje również z metoksyetanem (po prawej), więc są izomerami.
Rodzaje izomerii
→ płaski izomer
Jest to rodzaj izomerii, który bada różnice strukturalne między izomerami.
) Zawód
Jest to rodzaj płaskiej izomerii, w której różnica między substancjami opiera się na różnicy między funkcjami organicznymi, do których one należą. Zobacz kilka przykładów:
Propanon i propan:
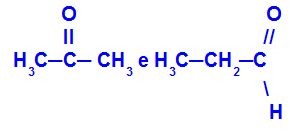
Izomery spełniające różne funkcje
Propanon (po lewej) należy do grupy ketonowej, a propanal (po prawej) należy do grupy aldehydowej.
B) Więzienie
Jest to rodzaj płaskiej izomerii, w której różnica między substancjami opiera się na różnicy między łańcuchami, które one prezentują. Zobacz przykład:
2-metylopropan i butan
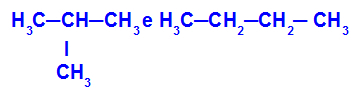
Izomery posiadające łańcuchy o różnych klasyfikacjach
W przykładzie widzimy, że 2-metylopropan (po lewej) ma łańcuch rozgałęziony, a butan (po prawej) ma normalny łańcuch.
do) Pozycja
Jest to rodzaj izomerii płaskiej, w której różnica między substancjami opiera się na różnicy położenia składnika obecnego w ich łańcuchach. Zobacz przykład:
1-chloropropan i 2-chloropropan
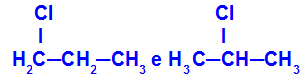
Izomery, których składniki znajdują się w różnych pozycjach w łańcuchu
W przykładzie widzimy, że 1-chloropropan (po lewej) ma chlor umieszczony na węglu 1, a 2-chloropropan (po prawej) ma chlor umieszczony na węglu 2.
re) Metameria lub rekompensata
UWAGA: Izomeria obowiązuje wyłącznie dla łańcuchów heterogenicznych.
Jest to rodzaj izomerii płaskiej, w której różnica między substancjami polega na różnicy położenia heteroatomu obecnego w ich łańcuchach. Zobacz przykład:
Przykład: Metoksypropan i etoksyetan
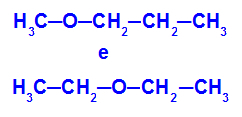
Izomery, które mają heteroatomy w różnych pozycjach w łańcuchu
W przykładzie widzimy, że w metoksypropan (po lewej) tlen ma rodnik z jednym węglem po jednej stronie i trzema atomami węgla po drugiej. W etoksyetanie (po prawej) tlen ma rodnik z dwoma węglami po jednej stronie i dwoma węglami po drugiej.
i)Tautomery
Jest to szczególny przypadek izomerii funkcji płaskiej i występuje tylko w trzech funkcjach organicznych:
Aldehyd
keton;
Enoli
Ten rodzaj izomerii polega na tym, że istnieje równowaga chemiczna między enolem i aldehydem oraz między enolem i ketonem, to znaczy, że składniki te są stale przekształcane w siebie. Zobacz przykład:
Prop-2-en-1-ol i propanon
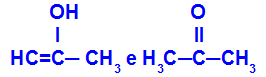
Izomery spełniające różne funkcje
W przykładzie widzimy, że Prop-2-en-1-ol (po lewej) należy do grupy enoli, a propanon (po prawej) do grupy ketonów, a więc są izomerami tautomery.
→ Izomeria kosmiczna
Jest to rodzaj izomerii zdefiniowanej przez analizę przestrzenną cząsteczki.
a) Izomery geometryczne
Teraz nie przestawaj... Po reklamie jest więcej ;)
Jest to rodzaj izomerii przestrzennej, który występuje, gdy substancja posiada cząsteczki o następujących cechach:
Zamknięty łańcuch, który ma dwa węgle z dwoma różnymi ligandami, jak w poniższym przykładzie:

Zamknięta struktura z geometryczną izomerią
Otwarty łańcuch, który ma podwójne wiązanie między węglami, a w każdym z tych węgli podwójnego wiązania znajdują się dwa różne ligandy, jak w poniższym przykładzie:
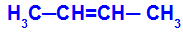
Otwarta struktura z geometryczną izomerią
Izomeria geometryczna dzieli się na dwie grupy:
1O Grupa: cis-trans
Występuje, gdy dwa ligandy jednego węgla są ściśle równe dwóm ligandom drugiego węgla, zarówno w strukturze otwartej, jak i zamkniętej.
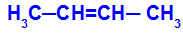
Łańcuch substancji o izomerii cis-trans
Izomer będzie nazywany cis, gdy te same ligandy znajdują się w tej samej płaszczyźnie.

Przykład izomeru cis
Izomer będzie nazywany trans, gdy różne ligandy znajdują się na tej samej płaszczyźnie.

Przykład izomeru trans
2O Grupa: E-Z
Występuje, gdy dwa ligandy jednego węgla są różne w stosunku do dwóch ligandów drugiego węgla, albo w strukturze otwartej, albo w strukturze zamkniętej.

Łańcuch substancji o izomerii E-Z
Izomer zostanie nazwany E, gdy ligandy o najwyższej liczbie atomowej znajdują się w przeciwnych płaszczyznach. W poniższym przykładzie węgiel po lewej stronie ma Br o najwyższej liczbie atomowej (35), a w drugim jest tlen (8).
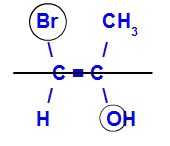
Przykład E-izomeru
Izomer zostanie nazwany Z, gdy ligandy o najwyższej liczbie atomowej będą w tej samej płaszczyźnie. W poniższym przykładzie węgiel po lewej stronie ma Br o najwyższej liczbie atomowej (35), a w drugim jest tlen (8).

Przykład izomeru Z
B) izomer optyczny
Jest to rodzaj izomerii przestrzennej, który występuje tylko wtedy, gdy substancja ma cząsteczki z chiralny węgiel (ten, który ma cztery różne ligandy) w swoich strukturach. Cząsteczka z chiralnym węglem ma zdolność polaryzacji i odchylania światła w następujący sposób:
W prawo (izomer prawostronny)
W lewo (izomer lewoskrętny)
Związek o aktywności optycznej zawsze ma aktywne izomery (tzw. antypody optyczne) i nieaktywne izomery (mieszanina dwóch aktywnych izomerów, mieszanina zwana racemiczną).
Możemy użyć następującego wzoru, aby określić liczbę aktywnych (IOA) i nieaktywnych (IOI) izomerów związku, który ma chiralny węgiel:
IOA = 2Nie
IOI = 2Nie
2
Poniżej znajduje się przykład związku, który ma izomerię geometryczną:
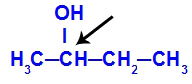
Węgiel chiralny zawarty w butan-2-olu
Struktura butan-2-olu ma następujące ligandy:
metyl (CH3)
Etyl (CH3-CH2)
Wodór (H)
Hydroksyl (OH)
Ponieważ ma tylko jeden chiralny węgiel, dlatego butan-2-ol ma:
Aktywne izomery:
IOA = 21
IOA = 2
Izomery nieaktywne:
IOI = 21
2
IOI = 2
2
IOI = 1
Przeze mnie Diogo Lopes Dias
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
DNI, Diogo Lopes. „Co to jest izomeria?”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-isomeria.htm. Dostęp 27 czerwca 2021 r.
