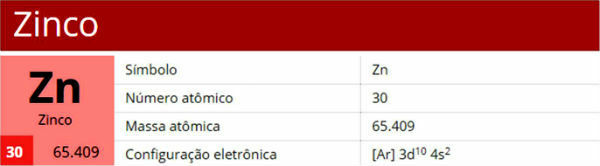
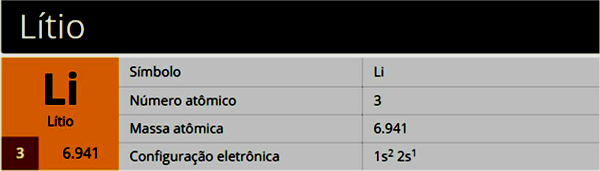
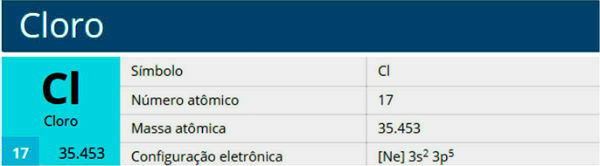
TEN Chemia organiczna jest częścią chemii, która z roku na rok zyskuje na znaczeniu na egzaminach wstępnych oraz w Enem, zwłaszcza przedmiot reakcje organiczne. Mając to na uwadze, poniżej będziesz mieć dostęp do podstawowych wskazówek dotyczących reakcji organicznych, które ułatwią Ci naukę!
1.) Jak rozpoznać a spalanie
Reakcja spalania to taka, w której dowolny związek organiczny (taki jak metan) reaguje z gazowym tlenem, tworząc wodę i gaz węglowy (taki jak dwutlenek węgla).
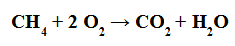
Równanie przedstawiające spalanie związku organicznego
2.) Jakie produkty powstają w reakcji spalania?
Produkty powstające w reakcji spalania zależą od rodzaju spalania:
Całkowite spalanie: to ta, w której powstaje woda i dwutlenek węgla (CO2) .
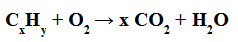
Przykład pełnego równania spalania
Niepełne spalanie: to ten, w którym dochodzi do powstawania wody i tlenku węgla (CO).

Przykład niepełnego równania spalania
3.) Jakie są substancje biorące udział w reakcji fotosynteza?
Reakcja fotosyntezy zachodzi, gdy cząsteczki dwutlenku węgla reagują z cząsteczkami wody, w obecności światła i chlorofilu, tworząc cząsteczki węglowodanów (takich jak glukoza).
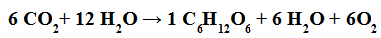
Równanie chemiczne reprezentujące fotosyntezę
Reakcje addycji to te, w których wiązania pi w łańcuchu są zerwane, a każdy z węgli tworzących te wiązania otrzymuje nowe atomy.
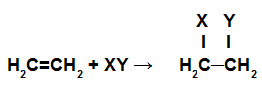
Schematyczne przedstawienie reakcji addycji
5th) Jakie są możliwe reagenty reakcji addycji?
Substancje organiczne powszechnie stosowane w reakcji addycji to:
alken: Substancja organiczna utworzona tylko przez węgle i wodory, w otwartym łańcuchu z podwójnym wiązaniem.
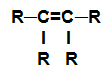
Wzór strukturalny alkenu
UWAGA: Grupa R może być rodnikiem lub pierwiastkiem wodorowym.
alkin: Substancja organiczna utworzona wyłącznie przez węgle i wodory, w otwartym łańcuchu z potrójnym wiązaniem.
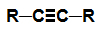
Wzór strukturalny alkinu
alkadien: Substancja organiczna utworzona wyłącznie przez węgle i wodory, w otwartym łańcuchu z dwoma podwójnymi wiązaniami.
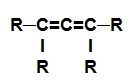
Wzór strukturalny alkadienu
Cyklan:Substancja organiczna zbudowana wyłącznie z węgli i wodorów, w zamkniętym i nasyconym łańcuchu.
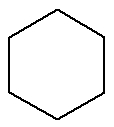
Wzór strukturalny cyklanu
Cykl: Substancja organiczna zbudowana wyłącznie z węgli i wodorów, w zamkniętym i nasyconym łańcuchu.
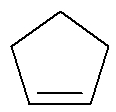
Wzór strukturalny cyklu
Benzen
Substancja organiczna utworzona przez zamknięty łańcuch i składająca się z sześciu węgli, trzech naprzemiennych wiązań podwójnych i sześciu atomów wodoru.

Wzór strukturalny benzenu
6.) Jakie są możliwe produkty reakcji addycji?
Produkty reakcji addycji zależą od substancji, która reaguje ze związkami organicznymi (alken, alkin, alkadien itp.). Zobacz główne reakcje addycji i ich możliwe produkty:
Są to reakcje, w których oprócz substancji organicznej jednym z reagentów musi być wodór (H2). W tej reakcji wiązanie pi zostaje zerwane, a każdy z węgli tworzących wiązanie otrzymuje atom wodoru. Jeśli istnieje więcej niż jedno łącze pi, proces jest powtarzany. Powstaje węglowodór.
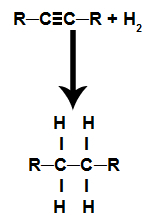
Równanie przedstawiające uwodornienie alkinu
Są to reakcje, w których oprócz substancji organicznej jeden z reagentów musi być prostą substancją utworzoną przez fluorowiec. W tej reakcji wiązanie pi zostaje zerwane, a każdy z węgli tworzących wiązanie otrzymuje atom halogenu. Jeśli jest więcej niż jedno pi, proces się powtarza.
Będziemy mieli formację halogenki organiczne sąsiednie (te, w których dwa węgle w łańcuchu są sąsiadami i zawierają halogen).
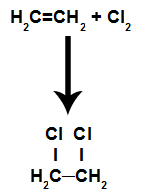
Równanie przedstawiające chlorowanie alkenu
c) Dodawanie przez halogenek kwasowy
Są to reakcje, w których oprócz substancji organicznej jednym z odczynników musi być halogenek kwasowy (HCl, HBr, HI, HCl). W tej reakcji wiązanie pi zostaje zerwane, a wodór w kwasie przechodzi do jednego węgla, a halogen do drugiego. Jeśli jest więcej niż jedno pi, proces się powtarza. Będziemy mieli tworzenie się węglowodoru.
Teraz nie przestawaj... Po reklamie jest więcej ;)
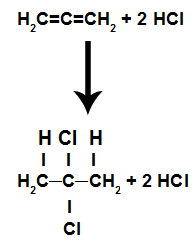
Równanie przedstawiające dodatek halogenku kwasowego alkadienu
d) Nawodnienie
Są to reakcje, w których oprócz substancji organicznej jednym z reagentów musi być woda (H2O). W tej reakcji wiązanie pi zostaje zerwane i wodór w wodzie przechodzi do jednego węgla, a grupa OH w wodzie przechodzi do innego węgla. Jeśli jest więcej niż jedno pi, proces się powtarza. Będziemy mieli tworzenie się węglowodoru.
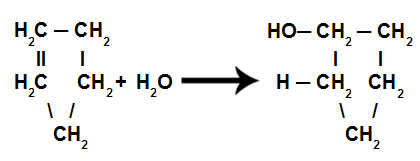
Równanie przedstawiające hydratację cyklenową
7.) Jak rozpoznać reakcję podstawienia?
Reakcja podstawienia to taka, w której związek organiczny wymienia jeden lub więcej atomów wodoru na atom lub grupę substancji, która z nim reaguje.

Schematyczne przedstawienie reakcji podstawienia
8. Jakie są możliwe reagenty reakcji podstawienia?
Substancje organiczne powszechnie stosowane w reakcji substytucji to:
alkany: Substancja organiczna zbudowana wyłącznie z węgli i wodorów, w łańcuchu otwartym i nasyconym.
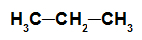
Wzór strukturalny alkanu
Benzen
Już zademonstrowano w 5. końcówce.
→ Pochodne benzenu: substancje organiczne, w których jeden lub więcej wodorów jest wymienianych na inne atomy lub różne grupy.
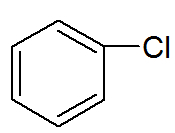
Wzór strukturalny pochodnej benzenu
halogenek organiczny
Substancja organiczna utworzona z atomów węgla, wodoru i jednego lub więcej halogenów (chloru, bromu, jodu i fluoru), w łańcuchu otwartym lub zamkniętym, nasycona lub nienasycona.

Wzór strukturalny halogenku organicznego
9. Jakie są możliwe produkty reakcji podstawienia?
Produkty reakcji podstawienia zależą od substancji, która reaguje ze związkami organicznymi. Zobacz główne reakcje wymiany i ich możliwe produkty:
a) Halogenacja
Są to reakcje, w których oprócz substancji organicznej jeden z reagentów musi być prostą substancją utworzoną przez halogen.
W tej reakcji wodór w związku organicznym jest zastępowany przez atom halogenu, tworząc halogenek kwasowy i kwas nieorganiczny.

Równanie przedstawiające chlorowanie alkanu
Reakcja, w której związek organiczny reaguje z kwasem azotowym (HNO3). W tej reakcji związek traci wodór i otrzymuje grupę nitrową (NO2), w wyniku czego związek nitro oraz wodę, niezależnie od tego, który związek organiczny przereagował z kwasem.
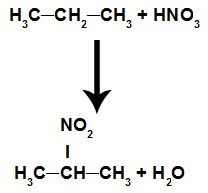
Równanie przedstawiające nitrowanie alkanów
Reakcja, w której związek organiczny reaguje z kwasem siarkowym (H2TYLKO4). W tej reakcji związek traci wodór i otrzymuje grupę sulfonową (SO3H), w wyniku czego kwas sulfonowy oraz wodę, niezależnie od tego, który związek organiczny przereagował z kwasem.

Równanie przedstawiające sulfonowanie benzenu
Reakcja, w której związek organiczny reaguje z halogenkiem organicznym. W tej reakcji związek organiczny traci wodór i otrzymuje rodnik, który był przyłączony do halogenu w halogenku organicznym. Reakcja skutkuje węglowodór oraz kwas nieorganiczny, niezależnie od tego, który związek organiczny przereagował z kwasem.

Równanie przedstawiające alkilowanie benzenu
Reakcja, w której związek organiczny reaguje z a halogenek kwasowy.
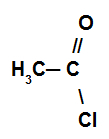
Przykład halogenku kwasowego
W tej reakcji związek organiczny traci wodór i otrzymuje grupę acylową z halogenku kwasowego.
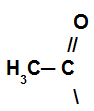
Reprezentacja grupy acylowej halogenku kwasowego
W wyniku reakcji powstaje a keton; oraz kwas nieorganiczny, niezależnie od tego, który związek organiczny przereagował z kwasem.
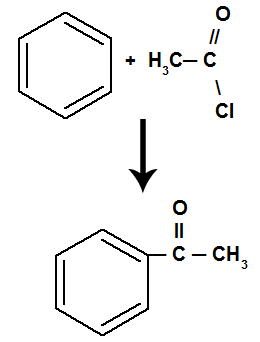
Równanie przedstawiające acylowanie benzenu
Przeze mnie Diogo Lopes Dias
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
DNI, Diogo Lopes. „Podstawowe wskazówki dotyczące reakcji organicznych”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/dicas-fundamentais-sobre-reacoes-organicas.htm. Dostęp 28 czerwca 2021 r.