*Teoria Arrheniusa:
W oparciu o jego eksperymenty z przewodnością elektryczną w środowiskach wodnych, chemiczne, fizyczne i matematyczne Szwedzki Svante August Arrhenius (1859-1927) zaproponował w 1884 roku następujące koncepcje definiowania kwasów i podstawy:

Tak więc ogólnie mamy:
H+ + H2O → H3O+
Przykłady:
HCl + H2O → H3O++ Cl-
HNO3+ H2O → H3O+ + NIE3-
H2TYLKO4+ 2 godz2O → 2H3O+ + OS42-

Przykłady:
NaOH → Na + + OH-
Ca(OH)2 →Ca2+ + 2 OH-
*Teoria Brönsteda-Lowry'ego:
Niezależnie Duńczyk Johannes Nicolaus Brönsted (1879-1947) i Anglik Thomas Martin Lowry (1874-1936), zaproponował w tym samym roku inną teorię kwasowo-zasadową znaną jako teoria Brönsteda-Lowry'ego, która mówi, że Następujący:

W tym przypadku jon wodorowy jest uważany za proton. Widać to w następującej reakcji, w której kwas cyjanowodorowy oddaje proton wodzie, która w związku z tym działa jak zasada:
HCN + H2O → CN- + H3O+
Ta reakcja jest odwracalna, z jonem hydroniowym (H3O+) może oddać proton jonowi CN-. Tak więc jon hydroniowy (H3O+) działa jak kwas, a CN- jako baza.
CN- + H3O+→ HCN + H2O
*Teoria Lewisa:
Teoria ta została stworzona przez amerykańskiego chemika Gilberta Newtona Lewisa (1875-1946) i mówi, co następuje:

Teraz nie przestawaj... Po reklamie jest więcej ;)
Teoria ta wprowadza nową koncepcję, jest bardziej wszechstronna, ale nie unieważnia teorii Brönsteda-Lowry'ego. Ponieważ każdy kwas Lewisa jest kwasem Brönsteda, a zatem każda zasada Lewisa jest zasadą Brönsteda. Dzieje się tak, ponieważ proton otrzymuje elektrony, co oznacza, że kwas Lewisa może łączyć się z samotną parą elektronów w bazie Lewisa.
Dla Lewisa reakcja kwasowo-zasadowa polega na tworzeniu bardziej stabilnego skoordynowanego wiązania kowalencyjnego. Więc kiedy zasada Lewisa przekazuje parę elektronów do zasady Lewisa, obie tworzą a koordynacyjne wiązanie kowalencyjne, w którym oba elektrony pochodzą od jednego z atomów, jak w przykładzie poniżej:
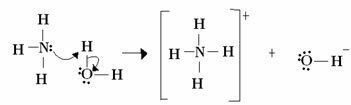
W tym przypadku amoniak działa jak zasada Lewisa i Brönsteda, ponieważ oddaje swoje dwa elektrony protonowi i dlatego jest odbiorcą protonu. Ponadto powstało wiązanie kowalencyjne między wodorem (protonem) a amoniakiem.
Już woda jest kwasem Lewisa i Brönsteda, ponieważ przekazuje proton i odbiera elektrony, zauważ, że tlen w wodorotlenku utworzonym z wody ma dodatkową parę elektronów.

Jennifer Fogaça
Absolwent chemii
Brazylijski zespół szkolny.
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
FOGAÇA, Jennifer Rocha Vargas. „Teorie kwasowo-zasadowe Arrheniusa, Brönsteda-Lowry'ego i Lewisa”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/teorias-acidobase-arrheniusbronstedlowry-lewis.htm. Dostęp 28 czerwca 2021 r.



