O Model atomowy Thomsona został zaproponowany w 1898 roku przez angielskiego fizyka Josepha Johna Thomsona lub po prostu JJ Thomsona. Po kilku eksperymentalne dowody na istnienie elektronuobalił teorię niepodzielności atomu zaproponowaną przez John Dalton.
Thomson na podstawie swojego modelu potwierdził i udowodnił istnienie elektrony (cząstki o ujemnym ładunku elektrycznym) w atomie, to znaczy atom ma cząstki subatomowe.
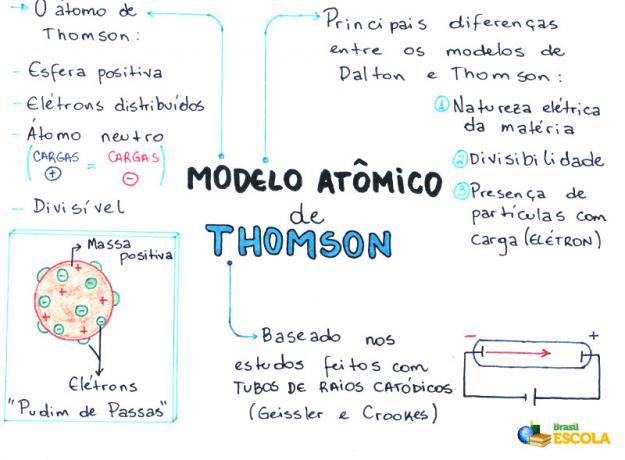
Mapa myśli: model atomowy Thomsona
* Aby pobrać mapę myśli w formacie PDF, Kliknij tutaj!
Thomson zaproponował swój model atomowy na podstawie odkryć związanych z radioaktywnością i eksperymentów przeprowadzonych z lampą katodową zbudowaną przez naukowców Geisslera i Crookesa. Zobacz reprezentację tej tuby:
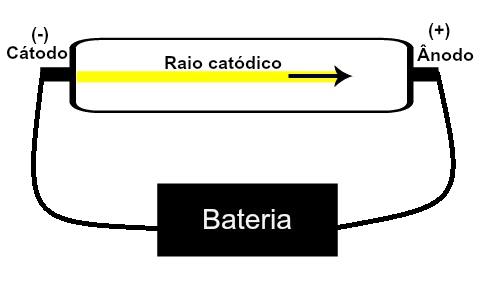
Gdy rozrzedzony gaz o niskim ciśnieniu zostanie poddany działaniu wysokiego napięcia elektrycznego (np. 15000 V), wytwarza wiązka światła (złożona z ładunków elektrycznych) z katody (biegun ujemny) w kierunku anody (biegun pozytywny).
Dzięki temu eksperymentowi Thomson doszedł do wniosku, że gdy atomy materiału gazowego w środku rurki zostały poddane działaniu wysokiego napięcia, ich elektrony zostały wyrwane i skierowane na płytkę pozytywny.
Rozważania zaproponowane przez model atomowy Thomsona
Dzięki eksperymentom przeprowadzonym z lampą katodową Thomson zaproponował swoją interpretację atomu i jego budowy. Tak więc, według niego:
- Atom jest kulą, ale nie masywnym, jak proponował Model atomowy Johna Daltona;
- Atom jest obojętny, ponieważ wszelka materia jest obojętna;
- Ponieważ atom ma elektrony, które mają ładunki ujemne, musi więc mieć cząstki dodatnie, aby ostateczny ładunek był zerowy;
- Elektrony nie są unieruchomione ani uwięzione w atomie, mogą zostać przeniesione do innego atomu pod pewnymi warunkami;
- Atom można uznać za ciągły płyn o dodatnich ładunkach, w którym rozprowadzone byłyby elektrony, które mają ładunek ujemny;
- powiązany twój model do budyniu z rodzynkami (które reprezentują elektrony);
- Ponieważ elektrony, które są rozproszone, mają ten sam ładunek, występuje między nimi wzajemne odpychanie, co powoduje, że są one równomiernie rozłożone w sferze.
Nowości proponowane atomowi przez model Thomsona
Model atomowy Thomsona był drugim proponowanym dla atomu. Pierwszy model został sformułowany przez Johna Daltona.
Teraz nie przestawaj... Po reklamie jest więcej ;)
Model Thomsona dotyczył nowej wiedzy o atomie, która do tej pory nie była proponowana z powodu braku podstaw naukowych, takich jak:
- Elektryczna natura materii;
- Rozszczepianie atomów;
- Obecność małych, naładowanych cząstek w atomie.
Problemy wskazane atomowi Thomsona
Kilku fizyków w momencie złożenia wniosku Model atomowy Thomsona, opierając się na teoriach fizyki klasycznej, wskazał na pewne niespójności obecne w tym modelu:
- Thomson zaproponował, że atom ma stabilność w odniesieniu do równomiernego rozkładu elektronów, który może być modyfikowany pod wpływem energii. Jednak fizyka klasyczna, oparta na elektromagnetyzm, nie pozwala na istnienie stabilnego układu opartego jedynie na odpychaniu między cząstkami o tym samym ładunku;
- W przypadku Thomsona elektrony są równomiernie rozmieszczone w atomie, ale mają zdolność: przesuwa się w sposób przyspieszony i dlatego musi emitować promieniowanie elektromagnetyczne o określonych częstotliwościach konkretny. Jednak tego nie zaobserwowano.
- Model Thomsona był często nieskuteczny w wyjaśnianiu właściwości atomowych, takich jak ich skład i organizacja.
* Mapa myśli autorstwa Victora Ricardo Ferreira
Nauczyciel chemii
Przeze mnie Diogo Lopes Dias
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
DNI, Diogo Lopes. „Model atomowy Thomsona”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/o-atomo-thomson.htm. Dostęp 27 czerwca 2021 r.
Chemia

Niels Bohr, atom Bohra, fizyka atomowa, stabilny atom, model atomowy, układ planetarny, warstwy elektrosfery, poziomy energetyczne, powłoki elektronowe, energia elektronów, model atomowy Rutherforda, atom w stanie wzbudzonym.
Chemia

Atomy a budowa Wszechświata, teoria atomowa, że wszystko jest zrobione, materia składa się z atomów, teoria czterech żywiołów, starożytni alchemicy, teoria atomowa, cząstka fundamentalna.

