Węglany to związki nieorganiczne powstające w wyniku wiązania jonowego metalu lub półmetalu z anionem węglanowym, CO32-.
Węgiel jest czterowartościowy, to znaczy ma cztery elektrony w powłoce walencyjnej i może tworzyć cztery wiązania kowalencyjne, aby być stabilnym, podczas gdy tlen jest dwuwartościowy, ma sześć elektronów w powłoce walencyjnej i jest w stanie utworzyć dwa wiązania, aby były stabilne, z ośmioma elektrony. Tak więc istnieje silna tendencja węgla do wiązania się z dwoma atomami tlenu, z których wszystkie są stabilne (O ═ C ═ O → WSPÓŁ2).
Ale inny tlen może łączyć się z węglem, ponieważ stosunek promieni jonowych prowadzi do liczby koordynacyjnej równej 3, tworząc strukturę trójkątny, w którym węgiel znajduje się w środku, tworząc podwójne wiązanie z jednym z atomów tlenu i dwa pojedyncze wiązania z pozostałymi dwoma tlen. Rezultatem są dwa nadmiarowe elektrony, ponieważ te dwa tleny nie są stabilne i każdy musi otrzymać jeden elektron:
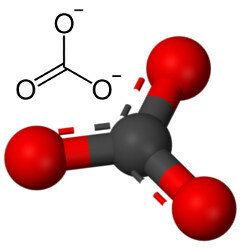
Anion węglanowy tworzą wiązania kowalencyjne, ale jego związki, które są solami nieorganicznymi i minerałami znane jako węglany, są jonowe, ponieważ ten rodnik otrzymuje dwa elektrony z jakiegoś metalu lub półmetalu, tworząc wiązanie jonowe.
Związki te są nierozpuszczalne w wodzie, z wyjątkiem węglanu amonu ((NH4)2WSPÓŁ3) i węglany utworzone z metali alkalicznych (pierwiastki z rodziny 1: Li, Na, K, Rb, Cs i Fr). Prawie wszystkie są białymi ciałami stałymi, jak pokazano na poniższym obrazku:

Dwa najczęstsze i najważniejsze codzienne przykłady węglanów to węglan sodu (Na2WSPÓŁ3) i węglan wapnia (CaCO3). W pierwszym przypadku sód należy do rodziny 1, ma elektron w powłoce walencyjnej i ma tendencję do utraty tego elektronu, aby stać się stabilnym. Ponieważ anion węglanowy musi otrzymać dwa elektrony, wiąże się z dwoma atomami sodu:
Teraz nie przestawaj... Po reklamie jest więcej ;)

Soda kalcynowana jest lepiej znana jako soda lub soda i jest używana do produkcji mydeł, barwników, leków, papieru oraz do uzdatniania wody basenowej. Ale jego głównym zastosowaniem jest węglan wapnia i piasek w produkcji szkła.
Wapń należy do rodziny 2, która ma tendencję do utraty dwóch elektronów. Tak więc atom wapnia wiąże się z rodnikiem węglanowym:

Węglan wapnia występuje w wapieniu i marmurze. W stalaktyty i stalagmity które istnieją w jaskiniach składają się z tego węglanu; muszle, rafy koralowe i skorupki jajek. Do bielenia ścian, pni drzew i innych miejsc używamy wodorotlenku wapnia (Ca(OH)2), który z czasem reaguje z atmosferycznym dwutlenkiem węgla, tworząc węglan wapnia.

Węglany są bardzo powszechne na powierzchni Ziemi, podobnie jak w przypadku minerałów. Jego retikulum krystaliczne może zmieniać się w przestrzeni na dwa sposoby: rombowo (jak w przypadku mineralnego aragonitu pokazanego powyżej wraz ze wzorem węglanu wapnia) oraz romboedryczny lub trygonalny, jak w przypadku kalcytu (inny minerał składający się z węglanu wapnia).
Węglany reagują w obecności kwasów uwalniając CO2, który jest łatwo widoczny poprzez musowanie.
Jennifer Fogaça
Absolwent chemii
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
FOGAÇA, Jennifer Rocha Vargas. „Węglany”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/carbonatos.htm. Dostęp 28 czerwca 2021 r.
Chemia

Węglan sodu, metoda Leblanc, metoda Ernesta Solvaya, soda kalcynowana, soda, zwykła produkcja szkła, uzdatnianie wody basenowej, kontrola pH wody, obróbka tekstyliów, dodatek do żywności.
Chemia

Sole codziennego użytku, węglan wapnia, chlorek sodu, fluorek sodu, azotan potasu, azotan sodu węglan sodu, wodorowęglan sodu, wodorowęglan sodu, siarczyn sodu, saletra, Soda.