Elektroliza to proces fizykochemiczny, który wykorzystuje energię elektryczną z dowolnego źródła (takiego jak: bateria lub baterii) w celu wymuszenia wystąpienia reakcji chemicznej prowadzącej do wytworzenia prostych lub złożonych substancji, których nie można znaleźć w naturze lub które nie występują w dużych ilościach.
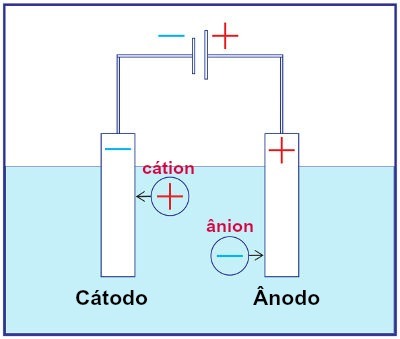
Reprezentacja montażu dowolnego systemu elektrolizy
Podczas elektrolizy kation ulega redukcji na katodzie, a anion utlenianiu na anodzie. Dzieje się to poprzez wyładowanie elektryczne dostarczane przez zewnętrzne źródło. Tak więc w elektrolizie zachodzi niespontaniczna reakcja utleniania i redukcji.
Teraz zrozum dwa sposoby, w jakie zachodzi elektroliza:
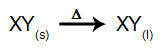
W tego rodzaju elektrolizie stosujemy a substancja jonowa w stanie ciekłym w kadzi elektrolitycznej. Gdy substancja jonowa (XY) ulega fuzji, podlega procesowi dysocjacja, jak przedstawiono poniżej:

Następnie, po włączeniu źródła zasilania, kation (X+) porusza się w kierunku katody, a aniony (Y-) przejdź w kierunku anody. A tym samym:
Na katodzie: kationy otrzymują elektrony (ulegają redukcji) i przekształcają się w substancję stabilną (X), proces ten przedstawia równanie:
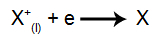
Na anodzie: aniony tracą elektrony (ulegają utlenieniu) i stają się stabilną substancją (X), co przedstawia równanie:

a) Przykład elektrolizy magmowej
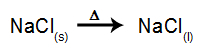
Jako przykład wykonaj teraz magmową elektrolizę chlorek sodu (NaCl). Kiedy chlorek sodu (NaCl) ulega fuzji, przechodzi proces dysocjacji, jak pokazano poniżej:
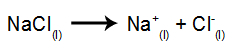
Następnie, po włączeniu źródła zasilania, kation (Na+) porusza się w kierunku katody, a aniony (Cl-) przejdź w kierunku anody. A tym samym:
Na katodzie: kationy w+ otrzymują elektrony (ulegają redukcji) i stają się stabilną substancją (Na, który jest metalem stałym), co przedstawia poniższe równanie:

Na anodzie: aniony Cl- tracą elektrony (ulegają utlenianiu) i stają się substancją stabilną (Cl2, który jest gazowy), proces reprezentowany przez poniższe równanie:

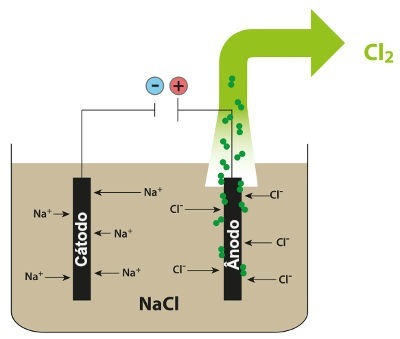
Schemat przedstawiający magmową elektrolizę NaCl
Tak więc w magmowej elektrolizie chlorku sodu powstaje metaliczny sód (Na) i gazowy chlor (Cl2).
W tego rodzaju elektrolizie wykorzystujemy substancję jonową rozpuszczoną w wodzie, wewnątrz zbiornika elektrolitycznego. Tak więc przed wykonaniem elektrolizy najpierw mieszamy substancję (najczęściej sól nieorganiczny) w wodzie, aby spowodować jej dysocjację (uwolnienie kationu i anionu), jak pokazano poniżej:
Teraz nie przestawaj... Po reklamie jest więcej ;)
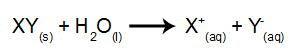
Różnica w stosunku do elektrolizy magmowej polega na tym, że oprócz jonów z dysocjacji mamy również jony z samojonizacji wody. W procesie samojonizacji woda wytwarza kation hydroniowy (H+) i anion wodorotlenkowy (OH-), jak w poniższym równaniu:

Tak więc wewnątrz kadzi elektrolitycznej mamy do czynienia z dwoma kationami (jeden z substancji) jonowy i jeden z wody) oraz dwa aniony (jeden z substancji jonowej, a drugi z Woda).
Aby wiedzieć, który kation zostanie przeniesiony do katody, a który anion do anody, konieczne jest poznanie kolejności odprowadzania kationów i anionów.
Dla kationów:
Au>Pt>Hg>Ag>Cu>Ni>Cd>Pb>Fe>Zn>Mn>hydronium>rodzina IIIA> rodzina IIA > rodzina IA
dla anionów
Aniony nieutlenione i HSO4 > wodorotlenek > utlenione aniony i F
Następnie, po włączeniu źródła zasilania, kation (X+) porusza się w kierunku katody, a jeden z anionów (Y-) przesuwa się w kierunku anody.
Na katodzie: kationy otrzymują elektrony (ulegają redukcji) i przekształcają się w substancję stabilną (X), co przedstawia poniższe równanie:

Na anodzie: aniony tracą elektrony (ulegają utlenianiu) i zamieniają się w stabilną substancję (Y), co przedstawia poniższe równanie:
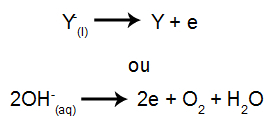
a) Przykład elektrolizy wodnej
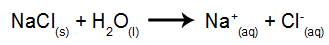
Jako przykład posłuży nam elektroliza wodna chlorku sodu (NaCl). Gdy chlorek sodu (NaCl) rozpuszcza się w wodzie, przechodzi proces dysocjacji, jak pokazano poniżej:
Oprócz dysocjacji NaCl mamy do czynienia z samojonizacją wody:

Więc mamy kationy H+ i dalej+ i aniony OH- i Cl-. Następnie po włączeniu źródła zasilania mamy:
na katodzie: kationy H+ odbierać elektrony (zredukowane) i stać się stabilną substancją (H2, który jest gazem). Dzieje się tak, ponieważ hydronium ma pierwszeństwo zrzutu przed pierwiastkami z rodziny IA (w tym przypadku Na). Proces przedstawia poniższe równanie:
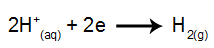
na anodzie: aniony Cl- tracą elektrony (ulegają utlenianiu) i stają się substancją stabilną (Cl2, który jest gazowy). To dlatego, że Cl the- jest anionem nieutlenionym i ma pierwszeństwo zrzutu przed wodorotlenkiem, proces ten przedstawia poniższe równanie:


Schemat przedstawiający elektrolizę wodną NaCl
Tak więc w elektrolizie wodnej chlorku sodu powstaje gazowy wodór (H2) i chloru gazowego (Cl2).
Przeze mnie Diogo Lopes Dias
Chemia

Zastosowania elektrolizy, galwanizacji, niklowania, chromowania, niklu, chromu, katody, sodu, aluminium, chloru, soda kaustyczna, wodór gazowy, elektroliza magmowa, elektroliza wodna, metale alkaliczne, ziemia alkaliczna, gaz chlor.