TEN teoria oktetów zaproponował Newton Lewis, który w badaniach zaobserwował, że zachodzi interakcja atomowa aby każdy element uzyskał stabilność elektroniczną gazu szlachetnego, czyli osiem elektronów w warstwa walencyjna. Jednak w niektórych cząsteczkach dochodzi do tego, co nazywa się rozszerzeniem lub skróceniem oktetu, to znaczy, że atom centralny ustanawia mniej lub bardziej przewidywalne wiązania.
Przeczytaj też: Wiązanie kowalencyjne - klasyfikacje i charakterystyka
Jak działa teoria oktetów?
Oczywiście wszystkie systemy mają tendencję do szukania sposobu na: uzyskać jak największą stabilność, i nie inaczej jest z atomem. Atomy to „cząstki podstawowe” dowolnej materii, a każdy z nich ma w swojej strukturze elektrosferę. Ta elektrosfera została podzielona przez Linus Pauling w poziomach energetycznych i podpoziomach. Pauling opracował diagram, aby zademonstrować, jak wyglądałby rozkład elektronów wokół jądra atomu.
Zobacz obrazek poniżej:
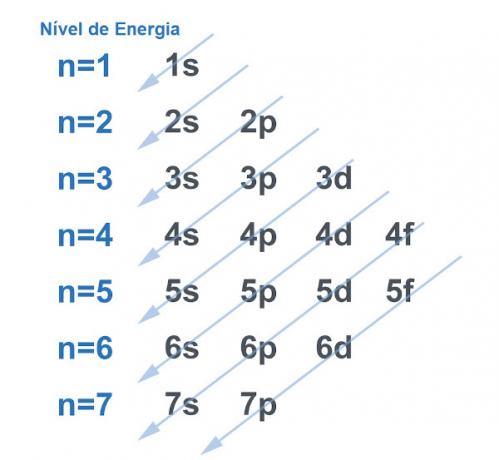
Każdy poziom i podpoziom zawiera elektrony
. Dokonując analogii, możemy powiedzieć, że każdy poziom to półka, a każdy podpoziom to pudełko. W każdym pudełku zmieścić dwa elektrony. Atom jest stabilny, gdy wszystkie jego elektrony są sparowane, to znaczy, gdy wszystkie pudełka mają po dwa elektrony.Przykład:
Zróbmy elektronową dystrybucję tlenu (O), który ma osiem elektronów w stanie naturalnym.
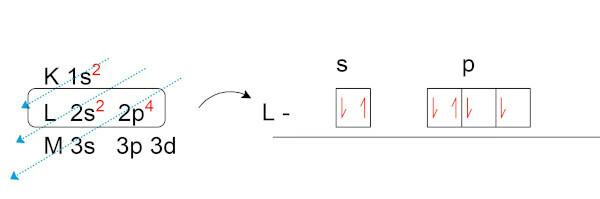
Zauważ, że w warstwie walencyjnej (warstwa L, na podpoziomie p) mamy dwa niesparowane elektrony. To właśnie te elektrony tworzą wiązania chemiczne z innymi pierwiastkami chce tworzyć pary elektroniczne.
Teoria oktetów opiera się na matematyce sumowania elektronów. Jeśli wszystkie podpoziomy ostatniej powłoki elektronowej mają po dwa elektrony, powłoka walencyjna będzie miała łącznie osiem elektronów, a w konsekwencji atom będzie stabilny.
Przeczytaj też: Liczby kwantowe - liczby związane z ilością energii elektronu
Teraz nie przestawaj... Po reklamie jest więcej ;)
Gazy szlachetne
Gazy szlachetne to jedyne pierwiastki, które można znaleźć w naturze w postaci monoatomowej, to znaczy bez nawiązywania wiązania z innym atomem. Dzieje się tak, ponieważ charakteryzują się stabilnością elektroniczną. Prawie wszystkie mają osiem elektronów w powłoce walencyjnej., przestrzegając zasady oktetu, z wyjątkiem helu, który ma tylko dwa elektrony.

Wyjątki od teorii oktetów
Niektórym związkom udaje się ustabilizować z więcej lub mniej niż ośmioma elektronami w powłoce walencyjnej. W takich przypadkach zdarzają się wyjątki od teorii oktetów.
rozszerzenie oktetu
Dzieje się tak głównie z fosforem (P) i siarką (S), które są stosunkowo dużymi atomami i mają podpoziom „d”. W tym przypadku atom zawiera w swojej ostatniej powłoce więcej niż osiem elektronów.
Przykład:
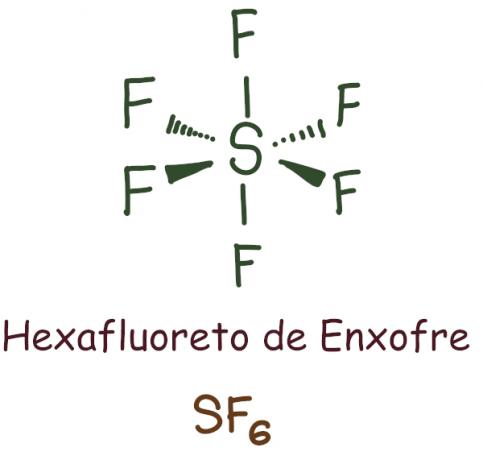
W przypadku sześciofluorku siarki centralny pierwiastek pozostawiono z 12 elektronów, przekraczając 8 wymaganych do stabilizacji zgodnie z regułą oktetu. W tym przypadku nastąpiło rozszerzenie oktetu.
skrócenie oktetu
Dzieje się z berylem (Be), borem (B) i niektórymi tlenki azotu. Zobacz przykład:
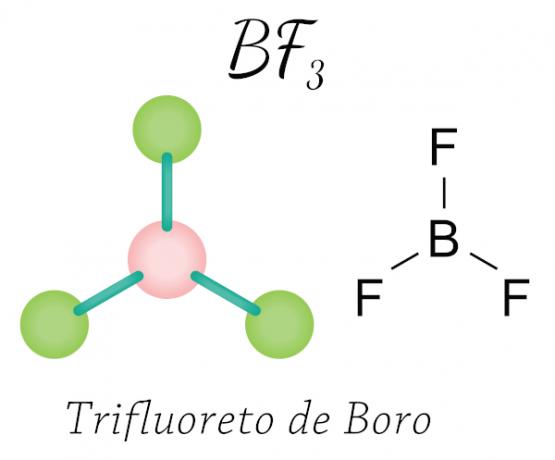
W przypadku trifluorku boru atomy fluoru uzyskują niezbędne osiem elektronów w powłoce walencyjnej, dzieląc się elektroniczna z borem, z poszanowaniem zasady oktetu, ale centralny atom (bor) nie stabilizuje się sześcioma elektronami, co powoduje jeden skrócenie oktetu.
Również dostęp: Klasyfikacja łącza sigma: jakie są kryteria?
rozwiązane ćwiczenia
Pytanie 1 - (Mackenzie-SP) Aby atomy siarki i potasu uzyskały konfigurację elektronową równą gazowi szlachetnemu, konieczne jest, aby:
(Dane: liczba atomowa S = 16; K = 19.)
A) siarka otrzymuje 2 elektrony, a potas 7 elektronów.
B) siarka daje 6 elektronów, a potas 7 elektronów.
C) siarka daje 2 elektrony, a potas 1 elektron.
D) siarka otrzymuje 6 elektronów, a potas oddaje 1 elektron.
E) siarka otrzymuje 2 elektrony, a potas oddaje 1 elektron.
Rozkład
Alternatywa E. Siarka jest elementem kolumny 16 lub rodziny 6A. Elementy tej rodziny mają tendencję do przyjmowania dwóch elektronów, tworząc pary elektronowe i mają łącznie osiem elektronów w powłoce walencyjnej. Pierwiastki z rodziny 1A, którymi są metale alkaliczne, mają tylko jeden elektron w powłoce walencyjnej. Oddając ten elektron, poprzednia warstwa staje się warstwą walencyjną, już z ośmioma elektronami, zgodnie z regułą oktetu.
Pytanie 2 - Oceń następujące stwierdzenia jako prawdziwe (T) lub fałszywe (F).
I ( ) Reguła oktetu mówi, że aby atom był stabilny, potrzeba ośmiu elektronów w powłoce walencyjnej.
II ( ) Warstwa walencyjna jest drugą warstwą elektronową atomu.
III ( ) Chlor (Cl), z rodziny halogenów, ma tendencję do zdobywania dwóch elektronów w celu uzyskania stabilności.
IV ( ) Sód (Na), element rodziny 1A, ma tendencję do utraty jedynego elektronu w swojej powłoce walencyjnej.
Zaznacz poprawną alternatywę:
A) I, III i IV są prawdziwe.
B) I i IV są prawdziwe.
C) Tylko II jest prawdziwe.
D) Tylko IV jest fałszywe.
E) Wszystkie są prawdziwe.
Rozkład
Alternatywa B. I i IV są prawdziwe. Stwierdzenie II jest błędne, ponieważ warstwa walencyjna jest ostatnią warstwą elektronową atomu, a nie drugą. A stwierdzenie III mówi, że chlor ma tendencję do zdobywania dwóch elektronów, co nie sprawdza się, ponieważ chlor pochodzi z Rodzina 7A lub 17, ma tendencję do uzyskiwania tylko jednego elektronu, aby w ten sposób uzyskać elektroniczną konfigurację gazu szlachetny.
Laysa Bernardes Marques de Araújo
Nauczyciel chemii