Reakcje odwracalne zwykle zaczynają się od pewnej ilości odczynników. Gdy rozpoczyna się reakcja bezpośrednia, z czasem odczynniki te są zużywane do tworzenia produktów, w konsekwencji stężenie odczynników spada, podczas gdy stężenie produktów wzrasta. Wtedy też rozpoczyna się reakcja odwrotna, wytwarzająca również substraty, aż tempo rozwoju (prędkości) reakcji bezpośredniej i odwrotnej pozostanie takie samo, osiągając tzw. równowaga chemiczna.
W równowadze istnieje stała równowagi Kc, która zasadniczo wyraża się wzorem:
|
Kc = [produkty]współczynnik w zrównoważonym równaniu chemicznym [odczynniki]współczynnik w zrównoważonym równaniu chemicznym |
To znaczy, biorąc pod uwagę następującą ogólną reakcję równowagi:
a A + b B ↔ c C + d D
Ponieważ małe litery to współczynniki, a duże to substancje, stała równowagi tej reakcji będzie wynosić:
Kc = [DO]do. [RE]re
[TA]. [B]b
Więcej szczegółów na ten temat można zobaczyć w tekście Stałe równowagi Kc i Kp. Ten tekst pokazuje nam również coś ważnego: że wartości Kc mogą nam pokazać, czy stężenie odczynników i produkty są równe lub jeśli jeden jest większy od drugiego, a w konsekwencji, jeśli równowaga chemiczna jest przesunięta w pewnym kierunku reakcja.
Musimy więc określić wartość Kc. Aby to zrobić, pamiętaj, że te obliczenia są eksperymentalne, więc spójrzmy na kilka przykładów reakcji i uzyskanych z nich danych.
Coś, co jest bardzo pomocne w wykonaniu tych obliczeń, to napisanie tabeli podobnej do tej pokazanej poniżej i wykonanie opisanych w niej kroków:

Tabela do uporządkowania danych wykorzystywanych do obliczenia stałej równowagi
Teraz przejdźmy do praktyki:
Przykład 1: W zamkniętym pojemniku o pojemności 2 l w temperaturze 100°C znajduje się 20 mol N2O4. Zaczyna zachodzić następująca reakcja odwracalna: N2O4 ↔ NIE2. Po pewnym czasie stwierdzono, że reakcja osiągnęła równowagę chemiczną i że 8 moli NO2 uformowały się. Jaka jest wartość stałej równowagi Kc w temperaturze 100°C?
Teraz nie przestawaj... Po reklamie jest więcej ;)
Rozkład:
Skorzystajmy z tabeli:

Tabela wykorzystana do rozwiązania przykładu obliczenia stałej równowagi
Zauważ, że w wierszu, w którym zapisano ilości, które reagują i tworzą, wiemy, że zużyto 4 mole N2O4, ponieważ stosunek wynosi 1:2, a powstało 8 moli NO2.
Teraz wystarczy zastąpić wartości znalezione w wyrażeniu stałej równowagi Kc tej reakcji:
Kc = [NA2]2
[N2O4]
Kc = (4 mol/L) 2
(8 mol/L)
Kc = 2 mol/L
Wartość Kc jest bezwymiarowa, nie ma jednostki związanej z jakąkolwiek wielkością.
Teraz spójrzmy na przykład, który zawiera również produkty od początku:
Przykład 2: W zamkniętym pojemniku o pojemności 5 L w temperaturze T znajdują się 2 mole gazowego wodoru, 3 mole gazowego jodu i 4 mole gazowego jodowodoru. Reakcja wchodzi w stan równowagi chemicznej w temperaturze T i okazuje się, że w naczyniu znajduje się 1 mol gazowego wodoru. Jaki jest wykres przedstawiający tę równowagę i jaka jest wartość stałej równowagi Kc w temperaturze T?
Rozkład:
Korzystanie z tabeli:
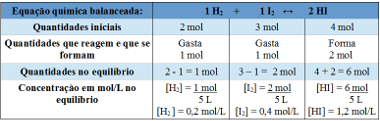
Tabela służąca do wyznaczenia stałej równowagi
Wykres przedstawiający zmiany stężeń mol/L odczynników i produktów do momentu osiągnięcia równowagi można przedstawić za pomocą wzoru:

Wykres równowagi chemicznej pokazujący zmiany stężeń odczynników i produktów
Teraz znajdujemy wartość stałej równowagi:
Kc =__[HI]2__
[H2 ]. [JA2]
Kc = (1,2)2
0,2. 0,4
Kc = 18
Jennifer Fogaça
Absolwent chemii
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
FOGAÇA, Jennifer Rocha Vargas. „Obliczanie stałej równowagi Kc”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/calculo-constante-equilibrio-kc.htm. Dostęp 28 czerwca 2021 r.
Chemia

Sprawdź swoją wiedzę i dowiedz się więcej dzięki tej liście rozwiązanych ćwiczeń dotyczących bilansów chemicznych. Dzięki temu materiałowi będziesz w stanie lepiej zrozumieć, jak pracować ze stałymi równowagi (Kp, Kc i Ki), przesunięciem równowagi, pH i pOH, a także równowagą w tak zwanych roztworach buforowych.



